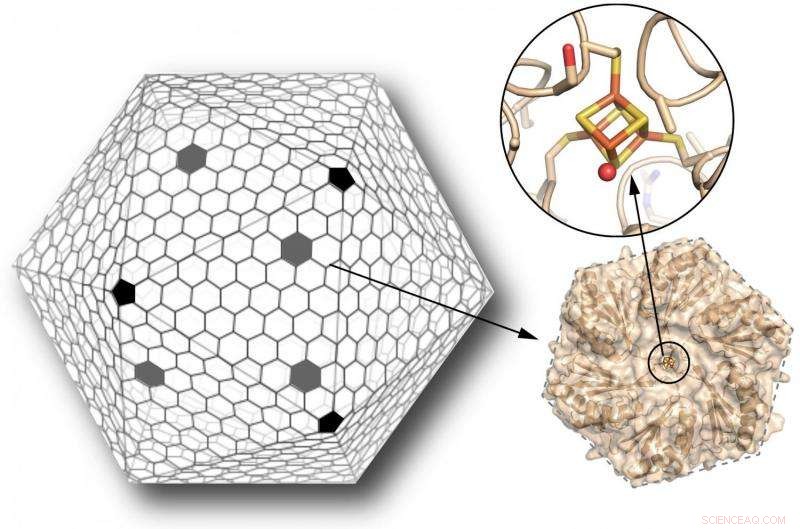
El caparazón de un microcompartimento bacteriano (o BMC) está compuesto principalmente por proteínas hexagonales, con proteínas pentagonales que cubren los vértices, similar a un balón de fútbol (izquierda). Los científicos han diseñado una de estas proteínas hexagonales, normalmente desprovisto de cualquier centro metálico, para unir un grupo de hierro-azufre (palos anaranjados y amarillos, superior derecha). Este grupo puede servir como un relé de electrones para transferir electrones a través de la capa. La introducción de esta nueva funcionalidad en la carcasa de un BMC amplía enormemente sus posibilidades como bio-nanoreactores personalizados. Crédito:Clement Aussignargues / MSU; Cheryl Kerfeld y Markus Sutter / Berkeley Lab
Los científicos han rediseñado por primera vez un componente básico de un nanocompartimento geométrico que se produce de forma natural en las bacterias. Introdujeron un sitio de unión de metal en su caparazón que permitirá que los electrones se transfieran hacia y desde el compartimento. Esto proporciona una funcionalidad completamente nueva, ampliando enormemente el potencial de los nanocompartimentos para que sirvan como fábricas químicas a medida.
Los científicos esperan adaptar este nuevo uso para producir productos químicos de alto valor, como medicamentos, Bajo demanda.
Los robustos nanocompartimentos, que son conchas poliédricas compuestas por lados en forma de triángulo y se asemejan a dados de 20 lados, están formados por cientos de copias de solo tres tipos diferentes de proteínas. Sus contrapartes naturales, conocidos como microcompartimentos bacterianos o BMC, encierran una amplia variedad de enzimas que llevan a cabo una química altamente especializada en bacterias.
Investigadores del Laboratorio Nacional Lawrence Berkeley del Departamento de Energía (Berkeley Lab) idearon estructuras de conchas sintéticas derivadas de las que se encuentran en una forma de varilla, bacteria que habita en los océanos, Haliangium ochraceum, y rediseñó una de las proteínas de la cáscara para que sirviera de andamio para un grupo de hierro-azufre que se encuentra en muchas formas de vida. El grupo se conoce como "cofactor" porque puede servir como molécula auxiliar en reacciones bioquímicas.
Los proyectiles basados en BMC son diminutos, Durable y naturalmente autoensamblado y autorreparable, lo que los hace más adecuados para una variedad de aplicaciones que las nanoestructuras completamente sintéticas.
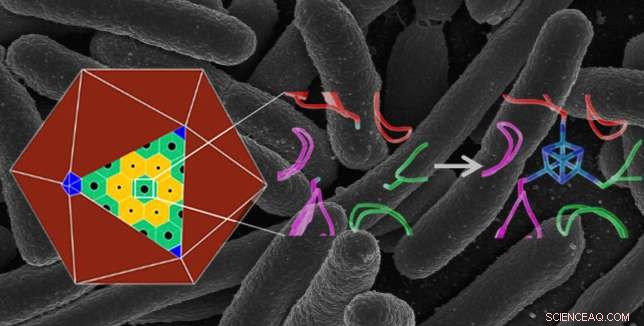
Estructura de proteína natural a escala atómica (centro) en un microcompartimento bacteriano poliédrico (izquierda), y una estructura diseñada (derecha) que une un grupo de hierro y azufre (en azul), dándole una nueva función. La proteína modificada se produjo en E. coli bacterias:la imagen de fondo muestra una imagen de micrografía electrónica de barrido de E. coli . Crédito:Berkeley Lab, Institutos Nacionales de Salud
"Esta es la primera vez que alguien introduce una funcionalidad en una capa. Pensamos que la funcionalidad más importante para introducir era la capacidad de transferir electrones dentro o fuera de la capa". "dijo Cheryl Kerfeld, un biólogo estructural en Berkeley Lab y autor correspondiente en este estudio. El grupo de investigación de Kerfeld se centra en BMC. Kerfeld tiene nombramientos conjuntos con la División de Biofísica Molecular y Bioimagen Integrada (MBIB) de Berkeley Lab, UC Berkeley y el Laboratorio de Investigación de Plantas MSU-DOE en la Universidad Estatal de Michigan (MSU).
"Eso mejora enormemente la versatilidad de los tipos de productos químicos que puede encapsular en la cáscara y el espectro de productos que se producirán, ", dijo." Por lo general, los caparazones se consideran simplemente barreras pasivas ".
Los investigadores utilizaron rayos X en la fuente de luz avanzada (ALS) de Berkeley Lab para mostrar, en 3-D y a escala atómica, cómo el grupo de hierro-azufre introducido se une a la proteína modificada.
El estudio está ahora en línea en el Revista de la Sociedad Química Estadounidense .
Las enzimas dentro de las BMC naturales pueden convertir el dióxido de carbono en compuestos orgánicos que pueden ser utilizados por las bacterias. aislar compuestos tóxicos o volátiles de la célula circundante, y llevar a cabo otras reacciones químicas que aporten energía a la célula.
En este estudio, Los investigadores introdujeron el grupo de hierro-azufre en los poros diminutos del bloque de construcción de la cáscara. Esta proteína diseñada sirve como un relé de electrones a través de la capa, que es clave para controlar la reactividad química de las sustancias dentro de la cáscara.
Clemente Aussignargues, el autor principal del estudio e investigador postdoctoral en el Laboratorio de Investigación de Plantas MSU-DOE en Michigan, dijo, "La belleza de nuestro sistema es que ahora tenemos todas las herramientas, en particular, la estructura cristalográfica de la proteína modificada, para modificar el potencial redox del sistema:su capacidad para absorber electrones (reducción) o emitir electrones (oxidación).
"Si podemos controlar esto, podemos ampliar la gama de reacciones químicas que podemos encapsular en la cáscara. El límite de estas aplicaciones será lo que pongamos dentro de las carcasas, no las conchas en sí ".
Él agregó, "Crear un nuevo microcompartimento desde cero sería muy, muy complicado. Es por eso que estamos tomando lo que la naturaleza nos presentó y tratando de agregar a lo que la naturaleza puede hacer ".
Para diseñar el sitio de encuadernación de metal, El grupo de Kerfeld primero tuvo que resolver las estructuras de los bloques de construcción del nanocompartimento para usar como plantilla para el diseño. Estos bloques de construcción se autoensamblan en carcasas sintéticas, que miden solo 40 nanómetros, o mil millonésimas de metro, en diámetro. La forma natural de las conchas puede ser hasta 12 veces más grande.
El cofactor hierro-azufre de la proteína modificada, que se produjo en la bacteria E. coli, fue muy estable incluso cuando se sometió a varios ciclos redox, una característica esencial para aplicaciones futuras, Dijo Aussignargues. "La proteína diseñada también era más estable que su contraparte natural, que fue una gran sorpresa, ", dijo." Se puede tratar con cosas que normalmente hacen que las proteínas se deshagan y se relajen ".
Un desafío importante en el estudio fue preparar la proteína diseñada en un ambiente libre de oxígeno para formar pequeños cristales que preservan mejor su estructura y su cofactor para imágenes de rayos X, Dijo Kerfeld. Los cristales se prepararon en una caja de guantes sellada al aire en MSU, congelado, y luego se envió para estudios de rayos X en el ALS de Berkeley Lab y en la Fuente de luz de radiación de sincrotrón de Stanford (SSRL) del Laboratorio de aceleración nacional de SLAC.
En el trabajo de seguimiento, el equipo de investigación está explorando cómo incorporar diferentes centros de metal en las carcasas de BMC para acceder a un rango diferente de reactividad química, ella dijo.
"Estoy trabajando para incorporar un centro de metal completamente diferente, que tiene un potencial de reducción muy positivo en comparación con el grupo hierro-azufre, "dijo Jeff Plegaria, investigador postdoctoral en el Laboratorio de Investigación de Plantas MSU-DOE que contribuyó al último estudio. "Pero es el mismo tipo de idea:impulsar electrones dentro o fuera del compartimento".
Él agregó, "El siguiente paso es encapsular proteínas que pueden aceptar electrones en las capas, y usar eso como una sonda para observar la transferencia de electrones desde el exterior del compartimento hacia el interior ". Eso acercará a los investigadores a la creación de tipos específicos de productos farmacéuticos u otros productos químicos.