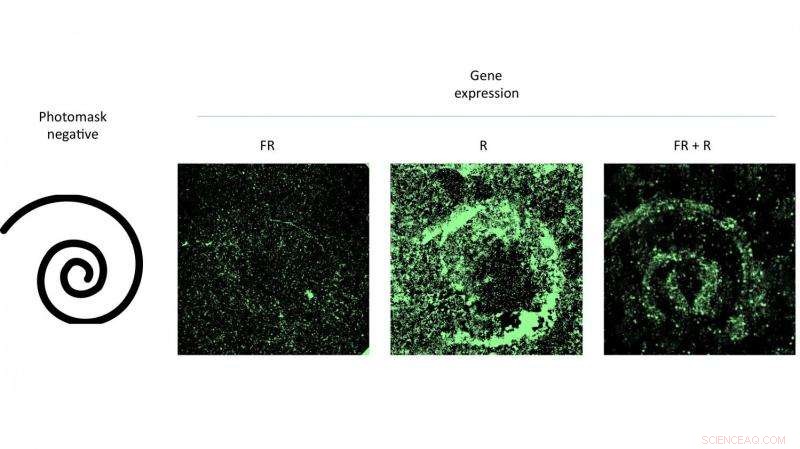
Golpear una placa de Petri de células que contenían un virus modificado con un patrón de luz roja fomentó la expresión génica que coincidía con el patrón. El experimento de científicos de la Universidad de Rice demostró la efectividad de un nuevo sistema de administración de genes que se puede controlar con luz. Crédito:Eric Gomez / Rice University
Light está ayudando a los científicos de la Universidad de Rice a controlar tanto la infectividad de los virus como la entrega de genes a los núcleos de las células diana.
Los investigadores han desarrollado un método para utilizar dos tonos de rojo para controlar el nivel y la distribución espacial de la expresión génica en las células a través de un virus modificado.
Aunque los virus han evolucionado para transportar genes a las células huésped, todavía enfrentan dificultades para llevar sus cargas útiles del citoplasma al núcleo de una célula, donde ocurre la expresión génica. Los laboratorios de arroz de los bioingenieros Junghae Suh y Jeffrey Tabor han encontrado con éxito una manera de superar este obstáculo crítico.
La investigación del equipo aparece esta semana en la revista American Chemical Society ACS Nano .
El resultado de los laboratorios de Rice's BioScience Research Collaborative combina el interés de Suh en el diseño de virus para entregar genes a las células diana con las habilidades de Tabor en optogenética. en el que se pueden usar proteínas sensibles a la luz para controlar el comportamiento biológico.
Construyeron vectores de virus adenoasociados (AAV) personalizados mediante la incorporación de proteínas que se unen naturalmente cuando se exponen a la luz roja (longitudes de onda de 650 nanómetros) y se rompen cuando se exponen al rojo lejano (longitudes de onda de 750 nanómetros). Estas proteínas que responden naturalmente a la luz ayudan a las cápsides virales, las cáscaras duras que contienen cargas genéticas, a entrar en los núcleos de la célula huésped.
AAV ha sido el vector de elección para la edición de genes mediante CRISPR / Cas9, una técnica que parece prometedora para curar algunas enfermedades genéticas, pero los núcleos celulares presentan un problema, Dijo Suh.

El estudiante graduado de la Universidad de Rice, Eric Gómez, sostiene una máscara en forma de espiral que usó para controlar los patrones de expresión genética en una placa de Petri. Las células del plato contenían un virus modificado que respondía a la luz roja y entregaba sus cargas genéticas a los núcleos de las células. Crédito:Jeff Fitlow / Rice University
"Los virus en general son relativamente eficientes para introducir genes en las células, pero aún experimentan grandes barreras limitantes, ", dijo." Si agrega estos virus a las células, la mayoría parece estar fuera del núcleo, y solo una pequeña fracción entra, cuál es el objetivo ".
Ella dijo que el equipo se basó en la experiencia del laboratorio Tabor en optogenética para aumentar la eficiencia de los AAV. "Jeff trabaja con muchos tipos diferentes de proteínas sensibles a la luz. El par particular que decidimos se identificó por primera vez en las plantas.
"La luz es realmente agradable porque puedes aplicarla externamente y puedes controlar muchos aspectos:en qué áreas está expuesta la luz, la duración de la exposición, la intensidad de la luz y, por supuesto, su longitud de onda, " ella dijo.
El par de proteínas comprende el fitocromo B y su socio de unión, el factor de interacción con el fitocromo 6 (PIF6), ambos encontrados en thale berro. Los investigadores generaron células huésped que expresan el fitocromo B marcado con una secuencia de localización nuclear, un pequeño péptido conocido por ayudar a transportar proteínas al núcleo de manera más eficaz. A continuación, se unió el PIF6 más pequeño a la superficie exterior de la cápside del virus.
"Cuando los virus se internalizan en una célula huésped, se acumulan alrededor del núcleo de forma natural, "Suh dijo." En condiciones no activadas, la mayoría de los virus están atrapados allí. Pero cuando iluminamos las células activando la luz roja, estas dos proteínas vegetales se dimerizan, se unen, y debido a la etiqueta de localización nuclear en el fitocromo B, el virus es arrastrado al núcleo ".
Esta es la primera vez que se utilizan proteínas optogenéticas para controlar la infectividad de los virus, ella dijo, agregando, "No pensamos que funcionaría tan bien como lo hizo".

El bioingeniero de la Universidad de Rice Junghae Suh, izquierda, y el estudiante graduado Eric Gomez dirigieron un estudio en el que las proteínas que responden a la luz ayudaron a las cápsides virales a entregar su contenido a los núcleos de las células. Los investigadores ven su técnica como una forma de controlar la expresión genética. Crédito:Jeff Fitlow / Rice University
Autor principal Eric Gomez, un estudiante de posgrado en el laboratorio de Suh, y el coautor Karl Gerhardt, un estudiante de posgrado en el laboratorio de Tabor, demostraron la técnica activando patrones de células infectadas con AAV en placas de Petri al iluminarlas con luz roja a través de máscaras.
Suh dijo que la plataforma podría usarse en el futuro para controlar qué células y tejidos expresan un gen y a qué nivel. La estrategia también podría encontrar uso en aplicaciones de ingeniería de tejidos como bioandamios para implantación. "Aquí, es posible que desee persuadir a las células madre para que se conviertan en las células correctas de alguna manera coordinada espacialmente, " ella dijo.
El uso en el cuerpo está más lejos, porque la luz roja aplicada externamente solo atraviesa el tejido hasta alcanzar los objetivos. "Por último, Dependerá del dispositivo que uses para entregar la luz, ", dijo." Pero imaginamos casos en los que podría usar un catéter para ir al lugar donde desea que los virus sean mucho más infecciosos ".
Suh dijo que los laboratorios de Rice están trabajando para hacer que la próxima generación de cápsidas sea más efectiva y más entregable. "Este es sólo el primer paso, ", dijo." Tenemos muchas preguntas, como '¿Realmente podemos hacer esto in vivo?' tipo de preguntas.
"Ha habido un puñado de artículos que intentan hacer que el proceso infeccioso por virus responda a la luz, pero fueron antes de la era de la optogenética, ", Dijo Suh." Estaban usando otros tipos de moléculas sintéticas para hacer que los virus respondan a la luz.
"Parece que usar lo que la madre naturaleza ya ha proporcionado en forma de proteínas sensibles a la luz funciona muy bien para nosotros".