
Los científicos han logrado registrar el potencial eléctrico a través de la membrana de las células cardíacas en contracción (símbolo). Crédito:Keystone / Science Photo Library / Beermedia / Fotolia / Montage
Por primera vez, Los científicos han logrado registrar la corriente en los canales de membrana de las células cardíacas en contracción. Para hacer esto, los científicos combinaron un microscopio de fuerza atómica con un método ampliamente utilizado para medir señales eléctricas en las células.
Los impulsos eléctricos juegan un papel importante en las células del cuerpo humano. Por ejemplo, Las neuronas utilizan estos impulsos para transmitir información a lo largo de sus ramas y el cuerpo también los utiliza para controlar la contracción de los músculos. Los impulsos se generan cuando las proteínas de los canales especiales se abren en la envoltura externa de las células, permitiendo que las moléculas cargadas (iones) entren o salgan de la célula. Estas proteínas se denominan canales iónicos. Desde la década de 1970, Se ha puesto a disposición de los investigadores un método que permite medir la actividad de estos canales, pero hasta ahora este método se ha utilizado principalmente en células que no se mueven. Los ingenieros eléctricos de ETH Zurich y los biólogos de la Universidad de Berna han desarrollado aún más el método, para que puedan registrar fácilmente la actividad de las células en movimiento, como batir las células del músculo cardíaco en una placa de cultivo de tejidos.
El método existente implica colocar una pipeta de vidrio contra la membrana externa de una célula. La abertura en la punta de la pipeta es tan pequeña que toca solo una fracción de la superficie celular. Idealmente, este pequeño parche de membrana celular tiene exactamente un canal iónico. El interior de la pipeta está lleno de un fluido conductor y un electrodo, lo que permite medir diferencias en la carga entre la parte exterior de la celda y el interior de la celda (es decir, un potencial eléctrico) y cambios temporales en este potencial resultantes de la actividad en los canales iónicos. El método se conoce como técnica de pinzamiento de parche porque la pipeta se utiliza para sujetar un parche de la membrana celular.
Microscopio de fuerza atómica con aguja de microinyección
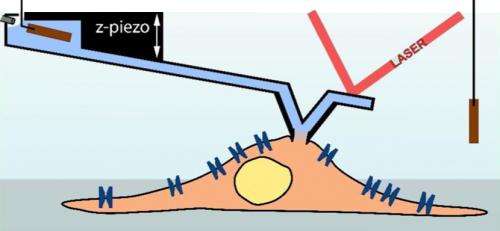
Una aguja de registro de microscopio de fuerza atómica (azul claro) sirve como pipeta para medir una célula (marrón claro; esquema). (Ilustración:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society) Una aguja de registro de microscopio de fuerza atómica (azul claro) sirve como pipeta para medir una célula (marrón claro; esquema). Crédito:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society
Dirigido por Tomaso Zambelli, profesor en el Instituto de Ingeniería Biomédica de ETH Zurich, y Hugues Abriel, profesor del Departamento de Investigación Clínica de la Universidad de Berna, los investigadores ahora han combinado esta técnica con un microscopio de fuerza atómica. La punta de un sensor se asienta sobre un soporte móvil, lo que se denomina voladizo, para escanear la superficie del objeto microscópico. Muchos años atrás, los investigadores lograron producir puntas de sensor con un canal interno, que permite la inyección controlada por computadora de moléculas en una célula. Esta técnica ahora está siendo comercializada por Cytosurge, una empresa derivada de ETH. Sin embargo, Los científicos continuaron el desarrollo de esta técnica al colocar un electrodo en la aguja de microinyección para realizar mediciones de pinza de parche. Los investigadores han publicado ahora los resultados exitosos de esta empresa en la revista Nano letras .
La técnica patch-clamp no es solo un método central para la investigación básica en biología celular, también se utiliza de forma rutinaria en el desarrollo de nuevos fármacos. Por ejemplo, la industria farmacéutica está obligada legalmente como parte del proceso de aprobación de nuevos medicamentos para probar si estos medicamentos interactúan con los canales iónicos. Un fármaco que bloquea los canales iónicos puede causar arritmia cardíaca grave en pacientes, que debe evitarse a toda costa.
Posibilidad de automatización y mediciones más largas
En el caso de la técnica convencional de pinza de parche, un operador coloca manualmente la pipeta contra la celda; aunque existen procedimientos automatizados, sus aplicaciones son limitadas. Por lo tanto, las células bajo prueba deben tener el mismo tamaño y forma y no deben moverse (como lo hacen las células cardíacas).
En el caso del nuevo método, la microaguja es controlada por una computadora que usa medidas de fuerza del microscopio de fuerza atómica para mantenerla a una distancia corta constante de la superficie celular. "Esto hace que el contacto entre la aguja y la célula sea mucho más estable, lo que nos permite tomar medidas durante un período de tiempo más largo e incluso probar celdas en movimiento, "explica Zambelli. Por primera vez, Así, los investigadores han logrado medir los cambios de potencial eléctrico en los canales iónicos de las células cardíacas que laten. Zambelli dice que también puede imaginarse el uso de esto como base para el desarrollo de un método automatizado para probar cualquier célula. independientemente de su forma o tamaño.