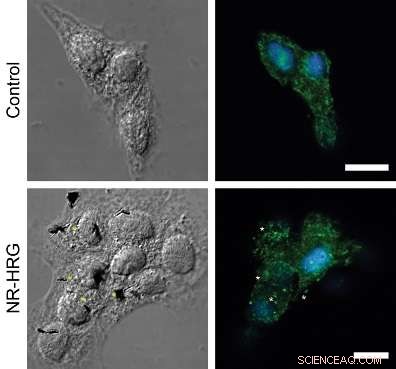
Figura:agrupación de receptores ErbB2 tras la unión de HRG-nanorod a células MCF7. Micrografías confocales que muestran una sección dorsal de células MCF7 objetivo (panel inferior) y no objetivo (panel superior). Los receptores ErbB2 (verde) se inmunotiñeron sin permeabilizar la membrana plasmática. Los núcleos se tiñeron con Hoechst 33342 (azul). Las estrellas indican ejemplos de grupos de receptores ErbB2 que están muy cerca de nanobarras.
Los investigadores de UCD han manipulado con éxito nanopartículas para apuntar a dos líneas celulares de cáncer de mama humano como una herramienta en el diagnóstico y tratamiento del cáncer.
El recubrimiento de nanopartículas con diferentes sustancias permite afinar su interacción con las células de una forma particular. Por ejemplo, el uso de una partícula ópticamente activa como el oro (Au) proporcionará un excelente contraste en las imágenes de infrarrojo cercano (NIR) y, si se calienta, realmente puede destruir el tejido circundante. A esto se le llama terapia de ablación fototérmica. Las partículas magnéticamente activas como el hierro (Fe) pueden permitir terapias físicas al generar calor cuando se exponen a campos magnéticos alternos que causan la muerte celular (hipertermia magnética).
El equipo de UCD dirigido por Conway Fellows, El profesor Gil Lee en la Facultad de Química y Biología Química y el profesor Walter Kolch en Biología de Sistemas de Irlanda, nanobarras sintetizadas con un segmento de hierro largo recubierto con polietilenglicol y una punta de oro corta recubierta con una sola capa de la proteína, herregulina (HRG).
HRG es un factor de crecimiento que se une y activa la familia de receptores de proteínas ErbB. ErbB2 se sobreexpresa en ciertos cánceres de mama y está relacionado con un mal pronóstico. Sin embargo, La sobreexpresión de ErbB2 conduce a una mayor sensibilidad a ciertos fármacos. El equipo cree que las nanovarillas funcionalizadas con Fe-Au utilizadas junto con estos fármacos podrían ser útiles en el tratamiento del cáncer.
Después de caracterizar y ajustar la interacción de las nanovarillas con las células, el equipo de investigación evaluó cómo responden las células a la estimulación mecánica. Para hacer esto, integraron unas pinzas electromagnéticas con un microscopio óptico y utilizaron un nuevo chip de microfluidos para monitorear la interacción de nanobarras individuales con dos líneas celulares de cáncer de mama humano que expresan la familia de receptores ErbB a diferentes velocidades. Cuando las nanovarillas HRG se unen a las células cancerosas que expresan ErbB, inician una cascada de eventos de señalización que conducen a la muerte celular.
"Usando pinzas magnéticas para estirar las células, pudimos activar aún más las vías de señalización celular para desencadenar la muerte celular. Esto fue incluso más efectivo para causar la muerte de las células cancerosas que la hipertermia magnética, el otro enfoque terapéutico que evaluamos ", explicó el Dr. Devrim Kilinc, primer autor e investigador del grupo Lee.
"Los resultados son una indicación positiva para el direccionamiento a nanoescala y la manipulación localizada de células cancerosas con un perfil de receptor específico".