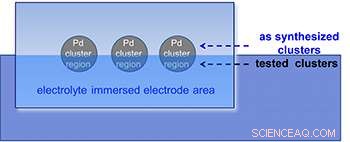
Un esquema del experimento de rayos X utilizado para determinar la estabilidad y composición del grupo (es decir, el estado de oxidación).
(Phys.org) —El sueño de una economía del hidrógeno:un mundo que funcione con H 2 gas, libre de la contaminación y la política de los combustibles fósiles, puede depender del desarrollo de una estrategia de eficiencia energética para dividir el agua en oxígeno e hidrógeno. El problema es que los enlaces de agua son muy estables, requiriendo grandes aportes de energía para romperse. Los científicos están desarrollando con entusiasmo catalizadores para reducir las demandas de energía, y por lo tanto el costo, de H 2 producción. Todavía, todavía luchan con lo básico, tales como las propiedades estructurales que constituyen un buen catalizador de disociación de agua.
Usando mediciones de la línea de luz 10-ID-B del Equipo de Acceso Colaborativo de Investigación de Materiales (MR-CAT) y la División de Ciencias de Rayos X 12-ID-C, Línea de luz D en la Fuente de Fotones Avanzados (APS) de la Oficina de Ciencia del Departamento de Energía de EE. UU. Los investigadores analizaron la estabilidad y composición de tres pequeños grupos de paladio — Pd 4 , Pd 6 , y Pd 17 —Que se están investigando como posibles catalizadores de disociación de agua. Luego generaron modelos estructurales de los catalizadores. Al combinar información sobre la identidad y estructura de cada grupo con su actividad catalítica, los investigadores identificaron un enlace Pd-Pd particular que parece ser esencial para la función catalítica. Esta investigación permitirá a los científicos diseñar mejores catalizadores para la división del agua.
La división electroquímica del agua ocurre en dos reacciones distintas:la reacción de desprendimiento de hidrógeno (HER), y la reacción de desprendimiento de oxígeno (REA). En este estudio, los investigadores, del Laboratorio Nacional Argonne, la Universidad de Birmingham (Reino Unido), y la Universidad de Yale se centró en los REA, que es actualmente la parte menos eficiente del proceso de separación del agua. Estudios anteriores demostraron que el platino metálico puede catalizar REA, pero esos materiales requieren una gran carga del costoso metal, generalmente presentes como grandes nanopartículas.
En busca de productos más rentables, más eficiente energéticamente, y opciones más activas, el estudio actual se centra en catalizadores de paladio con tamaños inferiores a un nanómetro.
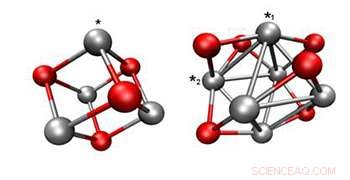
Posibles estructuras de Pd 4 O 4 (izquierda) y Pd 6 O 6 (derecha) generado por cálculos funcionales de densidad.
Típicamente, los catalizadores metálicos se esparcen de forma algo desordenada sobre las superficies de soporte, resultando en distribuciones desconocidas de átomos individuales, racimos y partículas más grandes. Para este estudio, los investigadores aislaron grupos de tamaños específicos enviando un haz molecular de iones de paladio a través de un espectrómetro de masas, filtrar todos los tamaños de partículas excepto los grupos de interés:Pd 4 , Pd 6 , y Pd 17 . Los racimos se depositaron inmediatamente, por separado, sobre un electrodo formado por una oblea de silicio recubierta con una fina película de nanodiamantes (primera figura).
Para probar la destreza catalítica de los pequeños grupos de paladio, los cátodos se sumergieron, Medio camino, en una solución básica, que es el medio estándar utilizado en REA. Luego, los investigadores realizaron voltamperometría, utilizando la corriente como una medida de la tasa de rotación de la reacción REA. La corriente generada por el cátodo que contiene Pd 4 los racimos no fue mejor, y tal vez un poco peor, que el electrodo solo. Sin embargo, el Pd 6 y Pd 17 los grupos mostraron una actividad significativa, con tasas de rotación que superan a las de trabajos anteriores en superficies metálicas de Pd y son comparables a las del iridio, el catalizador metálico más activo para REA.
El siguiente paso fue caracterizar las muestras de conglomerados. Los investigadores llevaron los mismos electrodos recubiertos de racimo utilizados en los estudios de voltamperometría al APS para su caracterización por espectroscopia de absorción de rayos X de incidencia rasante (GIXAS) en la línea de luz 10-ID-B y dispersión de rayos X de ángulo pequeño de incidencia rasante (GISAXS) en línea de luz 12-ID-C, D.
Una observación importante fue que los racimos sumergidos se ven prácticamente idénticos a los que no fueron sometidos a la reacción de oxidación del agua. lo que sugiere que ni la catálisis ni el duro entorno básico cambiaron la estructura de los clusters. Esa estabilidad es clave para desarrollar catalizadores duraderos. Los estados de oxidación medidos del Pd 4 y Pd 6 clusters se utilizó en cálculos funcionales de densidad que determinaron, para cada grupo, las configuraciones estructurales (segunda figura) así como la energía libre para cada paso del REA.
Los cálculos teóricos realizados utilizando el clúster de computación de alto rendimiento en el Centro de Materiales a Nanoescala de Argonne sugieren que los sitios puente Pd-Pd están activos para la reacción de evolución de oxígeno (REA) en Pd 6 O 6 . En general, Un descriptor clave para un catalizador de Pd REA eficiente es un equilibrio de las diferencias de energía de enlace con respecto al agua líquida para cada uno de los intermedios de reacción importantes (O, OH, y OOH). Para estos clústeres de Pd, OOH está más fuertemente unido que las otras especies, resultando en el sobrepotencial observado. El paquete de teoría funcional de densidad VASP se utilizó para obtener esta información sobre el mecanismo, y las estructuras de los grupos se obtuvieron utilizando el algoritmo genético de grupos de Birmingham.
Los investigadores concluyeron que la diferencia pertinente entre los grupos era la presencia de enlaces Pd-Pd particulares en los dos grupos más grandes, pero no en el grupo más pequeño. Sospechan que este vínculo puede ser necesario para la catálisis de REA, sugiriendo que las superficies catalíticas pueden verse obstaculizadas por especies inactivas. La esperanza es que con el conocimiento de lo que constituye una especie activa, los investigadores pueden centrarse en la fabricación de catalizadores de separación de agua utilizando solo los mejores grupos.