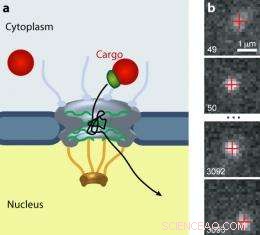
El complejo de poros nucleares (NPC) controla el tráfico de todas las moléculas entre el citoplasma y el núcleo de las células eucariotas. (a) Las cargas más grandes (rojo) requieren un receptor de transporte (verde) para pasar por la puerta. (b) Una carga de puntos cuánticos se mueve a través de un NPC. Imagen:Alan Lowe
(PhysOrg.com) - Los investigadores de UC Berkeley, Karsten Weis, Jan Liphardt, y sus colegas han utilizado sondas fluorescentes llamadas puntos cuánticos para determinar qué moléculas entran en el núcleo a través de sus nanoporos y cuáles son expulsadas. Sus hallazgos podrían ayudar a diseñar medicamentos que puedan atravesar los poros y apuntar al ADN de una célula.
Los biofísicos de QB3 han rastreado con una resolución sin precedentes las trayectorias de las cargas que se mueven a través del complejo de poros nucleares (NPC), una apertura selectiva a nanoescala que controla el acceso al núcleo de la célula, y respondió a varias preguntas clave sobre su función.
El NPC, un gran conjunto de proteínas con forma de red de baloncesto con flecos de tentáculos, es la puerta de entrada al núcleo celular, donde se almacena la información genética. Cada núcleo celular contiene aproximadamente 2, 000 NPC, incrustado en la envoltura nuclear. El NPC (que tiene unos 50 nanómetros de ancho) es responsable de todo el transporte dentro y fuera del núcleo. Para evitar que el contenido del resto del interior de la célula se mezcle con el del núcleo, el NPC discrimina entre cargas con gran precisión.
Varios virus se dirigen al NPC para ingresar al núcleo, y el transporte disfuncional entre el citoplasma y el núcleo se ha implicado en múltiples enfermedades, incluido el cáncer.
Los científicos han construido modelos para el NPC, pero la forma en que este canal opera y logra su selectividad sigue siendo un misterio. Se sabe que, para pasar por el NPC, las moléculas grandes deben unirse al menos a unos pocos receptores llamados "importinas"; No está claro si la unión de más importinas acelera o ralentiza el paso de una molécula. Entonces, también, tiene el punto exacto en el que una proteína transportadora llamada "Ran" juega un papel crucial, sustituyendo una molécula de GTP (un combustible celular, un análogo del ATP más conocido) por uno de GDP que la molécula grande trae consigo cuando ingresa al NPC.
Karsten Weis, un profesor de biología celular y molecular de UC Berkeley, Jan Liphardt, un profesor de física de UC Berkeley, y sus colegas llevaron a cabo experimentos de imágenes avanzados que resolvieron estos problemas. (Weis y Liphardt son miembros de QB3). La investigación se publicó el 1 de septiembre en la revista Naturaleza , en un artículo en el que el posdoctorado de Berkeley Alan Lowe y el estudiante de posgrado Jake Siegel fueron los primeros autores conjuntos.
Previamente, los científicos habían observado el movimiento de moléculas pequeñas (unos pocos nm de diámetro), etiquetado con etiquetas fluorescentes, a través del NPC. Pero el tránsito rápido y la débil señal de estas moléculas dieron como resultado escasa, datos difusos. Lowe, Siegel, et al. empleó "puntos cuánticos", que tienen unos 20 nm de diámetro y, por tanto, son más lentas que las moléculas más pequeñas y mucho más brillantes que los fluoróforos convencionales. Los investigadores cubrieron los puntos cuánticos con señales reconocidas por importinas. Usando una técnica microscópica que les permitió ver un plano, corte visual delgado a través de células vivas, vieron entrar cientos de puntos individuales, moviéndose en, siendo expulsado de, y en algunos casos admitido a través de, NPC. Los investigadores grabaron datos de video y rastrearon el movimiento de 849 puntos cuánticos con precisión nanométrica.
Los caminos espaguetis de los puntos cuánticos, superpuestos unos a otros, reveló que las partículas se dividían en tres clases:"abortos tempranos, ”Que fueron confinados brevemente y luego rebotaron; "Abortos tardíos, ”Que deambulaba y serpenteaba hasta el final interno del poro antes de salir por donde vinieron; y "éxitos, ”, Que siguieron los mismos caminos que los abortos tardíos, pero se les permitió la entrada.
De los erráticos meandros de los caminos, los investigadores dedujeron que los puntos cuánticos se estaban difundiendo al azar, en lugar de ser transportado activamente. Y agregar más importines al recubrimiento de los puntos acortó el tiempo de tránsito, sugiriendo que los importinos hacen que la carga entrante sea más soluble dentro del NPC en lugar de adherirse a las paredes interiores.
Los investigadores encontraron un resultado particularmente interesante cuando retuvieron la proteína portadora Ran del experimento. Sin Ran en la mezcla los puntos cuánticos siguieron exactamente el mismo rango de caminos que cuando Ran estaba presente, excepto que prácticamente ninguno pasó por el NPC.
Teniendo en cuenta los datos de su ruta, los autores dibujaron un modelo de cómo opera el NPC. La carga grande es capturada inicialmente por la franja de filamentos del NPC. Luego encuentra una constricción, a través del cual puede entrar en una especie de antecámara. Luego, en algunos casos, Ran intercambia el PIB de la carga por un GTP y es admitido en el núcleo. Solo el paso final es irreversible.
"Es un estudio elegante, "dice Michael Rout, profesor de biología celular y estructural en la Universidad Rockefeller cuya especialidad es el transporte NPC. "Si finalmente entendemos cómo opera el NPC al nivel más sutil, tal vez podríamos construir filtros para seleccionar moléculas de interés ".
En efecto, Una de las principales novedades es que la selectividad del NPC parece ser el resultado de una cascada de filtros, cada uno prefiere cargas correctas, en lugar de un solo paso muy selectivo. Esto ayuda a explicar por qué algunas cosas pueden entrar fácilmente en el núcleo y otras se excluyen. Este descubrimiento puede tener algunas implicaciones clínicas muy prácticas, Liphardt y Weis dicen. Puede permitir a los científicos desarrollar técnicas para entregar de manera eficiente grandes cargas artificiales, tales como conjugados de fármaco-polímero y agentes de contraste, al núcleo, que contiene el genoma.