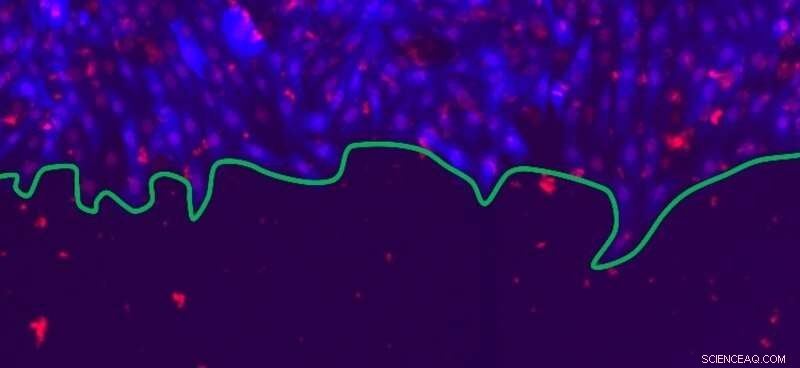
Imagen de microscopía fluorescente de un frente celular en proliferación, cuyo borde se indica en verde. Las células epiteliales de rata, con citoplasma (azul) y núcleos (rojo), Forman un cultivo bidimensional que se puede utilizar para modelar la cicatrización de heridas. Crédito:© Guillaume Rapin, UNIGE
En física de materiales, comprender cómo interactúan los sistemas a través de las interfaces que los separan es de interés central. Pero, ¿pueden los modelos físicos aclarar conceptos similares en sistemas vivos, como las celdas? Físicos de la Universidad de Ginebra (UNIGE), en colaboración con la Universidad de Zurich (UZH), utilizó el marco de los sistemas elásticos desordenados para estudiar el proceso de cicatrización de heridas:la proliferación de frentes celulares que finalmente se unen para cerrar una lesión. Su estudio identificó las escalas de las interacciones dominantes entre células que determinan este proceso. Los resultados, publicado en la revista Informes científicos , Permitirá un mejor análisis del comportamiento del frente celular, en términos de cicatrización de heridas y desarrollo de tumores. En el futuro, este enfoque puede ofrecer diagnósticos personalizados para clasificar los cánceres y orientar mejor su tratamiento, e identificar nuevos objetivos farmacológicos para el trasplante.
Al centrarse en las propiedades macroscópicas de grandes conjuntos de datos, La física estadística permite extraer una visión general del comportamiento del sistema independientemente de su carácter microscópico específico. Aplicado a elementos biológicos, como los frentes de las celdas que bordean una herida, este enfoque permite identificar las diversas interacciones que desempeñan un papel determinante durante el crecimiento de los tejidos, diferenciación, y sanación, pero sobre todo destacar su jerarquía en las diferentes escalas observadas. Patrycja Paruch, profesor del Departamento de Física de la Materia Cuántica de la Facultad de Ciencias de la UNIGE, explica:"Para la invasión de tumores cancerosos, o en caso de herida, la proliferación del frente celular es crucial, pero la velocidad y morfología del frente es muy variable. Sin embargo, Creemos que solo unas pocas interacciones dominantes durante este proceso definirán la dinámica y la forma, suave o rugosa, por ejemplo, del borde de la colonia celular. Las observaciones experimentales en múltiples escalas de longitud para extraer comportamientos generales pueden permitirnos identificar estas interacciones en tejido sano y diagnosticar a qué nivel pueden ocurrir cambios patológicos. para ayudar a combatirlos. Aquí es donde entra en juego la física estadística ".
Las muchas escalas de la curación de heridas
En este estudio multidisciplinario, los físicos de UNIGE colaboraron con el equipo del profesor Steven Brown de la UZH. Usando células epiteliales de rata, establecieron colonias planas (2D) en las que las células crecen alrededor de un inserto de silicona, posteriormente eliminado para imitar una lesión abierta. Los frentes celulares luego proliferan para llenar la abertura y curar el tejido. "Reproducimos cinco escenarios posibles" perjudicando "a las células de diferentes formas, para ver qué impacto tiene esto en la cicatrización de heridas, es decir, en la velocidad y rugosidad del frente de la celda, "explica Guillaume Rapin, investigadora del equipo de Patrycja Paruch. La idea es ver qué sucede en el tejido sano normal, o cuando se inhiben procesos como la división celular y la comunicación entre células vecinas, cuando la movilidad celular se reduce o cuando las células se estimulan farmacológicamente de forma permanente. "Tomamos unas 300 imágenes cada cuatro horas durante aproximadamente 80 horas, lo que nos permitió observar los frentes celulares en proliferación a escalas muy diferentes, "continúa Guillaume Rapin." Al aplicar técnicas computacionales de alto rendimiento, pudimos comparar nuestras observaciones experimentales con los resultados de simulaciones numéricas, "añade Nirvana Caballero, otro investigador del equipo de Patrycja Paruch.
Alejándose para un mayor efecto
Los científicos observaron dos regímenes de rugosidad distintos:a menos de 15 micrómetros, por debajo del tamaño de una sola celda, y entre 80 y 200 micrómetros, cuando varias células están involucradas. "Hemos analizado cómo el exponente de rugosidad evoluciona con el tiempo para alcanzar su equilibrio dinámico natural, dependiendo de las condiciones farmacoquímicas que hayamos impuesto a las células, y cómo esta rugosidad aumenta según la escala a la que miremos, "enfatiza Nirvana Caballero." En un sistema con una única interacción dominante, esperamos ver el mismo exponente de rugosidad en todas las escalas. Aquí, vemos una rugosidad cambiante si miramos la escala de una celda o de 10 celdas ".
Los equipos de Ginebra y Zurich revelaron solo variaciones menores en el exponente de rugosidad por debajo de 15 micrómetros, cualesquiera que sean las condiciones impuestas en los frentes celulares. Por otra parte, encontraron que entre 80 y 150 micrómetros, la rugosidad se ve alterada por todos los inhibidores farmacológicos, reduciendo significativamente el exponente de rugosidad. Es más, observaron que la velocidad de proliferación variaba mucho entre las diferentes condiciones farmacoquímicas, desaceleración cuando la división celular y la motilidad fueron inhibidas, y acelerándose cuando se estimulan las células. "Más sorprendentemente, la velocidad de proliferación más rápida se logró cuando se bloqueó la comunicación de unión entre células, ", dice Guillaume Rapin. Esta observación sugiere que dicha comunicación puede estar dirigida en terapias futuras, ya sea para promover la curación de quemaduras o heridas, o para retrasar la invasión del tumor canceroso.
Estos resultados muestran que las interacciones a mediana escala juegan un papel crucial en la determinación de la proliferación saludable de un frente celular. "Ahora sabemos a qué escala deben buscar los biólogos el comportamiento problemático de los frentes celulares, que puede conducir al desarrollo de tumores, ", dice Nirvana Caballero. Ahora los científicos podrán centrarse en estas escalas de longitud clave para sondear los frentes de las células tumorales, y comparar directamente sus interacciones patológicas con las de las células sanas.