
Investigadores de la Universidad de Tokio han encontrado una manera de mejorar la sensibilidad de las imágenes de fase cuantitativa existentes para que todas las estructuras dentro de las células vivas puedan verse simultáneamente. desde pequeñas partículas hasta grandes estructuras. Esta representación artística de la técnica muestra pulsos de luz esculpida (verde, arriba) viajando a través de una celda (centro), y salida (abajo) donde los cambios en las ondas de luz se pueden analizar y convertir en una imagen más detallada. Crédito:s-graphics.co.jp, CC BY-NC-ND
Los expertos en física óptica han desarrollado una nueva forma de ver el interior de las células vivas con mayor detalle utilizando la tecnología de microscopía existente y sin necesidad de añadir tintes o tintes fluorescentes.
Dado que las células individuales son casi translúcidas, Las cámaras de microscopio deben detectar diferencias extremadamente sutiles en la luz que pasa a través de partes de la célula. Esas diferencias se conocen como fase de la luz. Los sensores de imagen de la cámara están limitados por la cantidad de diferencia de fase de luz que pueden detectar, denominado rango dinámico.
"Para ver más detalles con el mismo sensor de imagen, debemos expandir el rango dinámico para que podamos detectar cambios de fase más pequeños de la luz, ", dijo el profesor asociado Takuro Ideguchi del Instituto de Ciencia y Tecnología de Fotones de la Universidad de Tokio.
El equipo de investigación desarrolló una técnica para tomar dos exposiciones para medir cambios grandes y pequeños en la fase de luz por separado y luego conectarlos sin problemas para crear una imagen final muy detallada. Llamaron a su método imágenes de fase cuantitativa de cambio de rango dinámico adaptativo (ADRIFT-QPI) y recientemente publicaron sus resultados en Luz:ciencia y aplicaciones .
"Nuestro método ADRIFT-QPI no necesita un láser especial, sin microscopios especiales o sensores de imagen; podemos usar células vivas, no necesitamos manchas ni fluorescencia, y hay muy pocas posibilidades de fototoxicidad, "dijo Ideguchi.
La fototoxicidad se refiere a matar células con luz, que puede convertirse en un problema con algunas otras técnicas de imagen, como imágenes de fluorescencia.
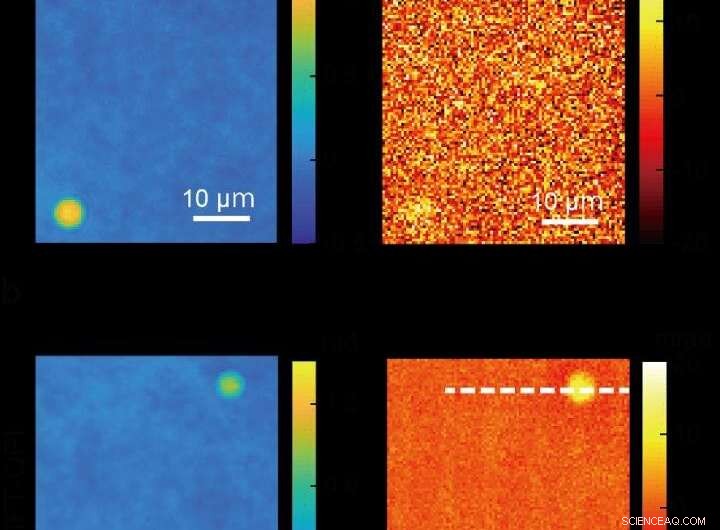
Imágenes de perlas de sílice tomadas con imágenes de fase cuantitativa convencional (arriba) y una imagen más clara producida con un nuevo método de microscopía ADRIFT-QPI (abajo) desarrollado por un equipo de investigación de la Universidad de Tokio. Las fotos de la izquierda son imágenes de la fase óptica y las imágenes de la derecha muestran el cambio de fase óptica debido a la absorción de luz del infrarrojo medio (específico molecular) por las perlas de sílice. En esta demostración de prueba de concepto, Los investigadores calcularon que lograron aproximadamente 7 veces mayor sensibilidad con ADRIFT-QPI que con QPI convencional. Crédito:Toda et al., CC-BY 4.0
Las imágenes de fase cuantitativa envían un pulso de una hoja plana de luz hacia la célula, luego mide el cambio de fase de las ondas de luz después de que pasan a través de la célula. Luego, el análisis por computadora reconstruye una imagen de las principales estructuras dentro de la célula. Ideguchi y sus colaboradores han sido pioneros en otros métodos para mejorar la microscopía de fase cuantitativa.
La obtención de imágenes de fase cuantitativa es una herramienta poderosa para examinar células individuales porque permite a los investigadores realizar mediciones detalladas, como rastrear la tasa de crecimiento de una célula en función del cambio en las ondas de luz. Sin embargo, el aspecto cuantitativo de la técnica tiene baja sensibilidad debido a la baja capacidad de saturación del sensor de imagen, por lo que el seguimiento de partículas de tamaño nanométrico dentro y alrededor de las células no es posible con un enfoque convencional.
El nuevo método ADRIFT-QPI ha superado la limitación del rango dinámico de las imágenes de fase cuantitativa. Durante ADRIFT-QPI, la cámara toma dos exposiciones y produce una imagen final que tiene una sensibilidad siete veces mayor que las imágenes tradicionales de microscopía de fase cuantitativa.
La primera exposición se produce con imágenes de fase cuantitativa convencional:se pulsa una hoja plana de luz hacia la muestra y se miden los cambios de fase de la luz después de que pasa a través de la muestra. Un programa de análisis de imágenes por computadora desarrolla una imagen de la muestra basada en la primera exposición y luego diseña rápidamente un frente de onda de luz esculpido que refleja esa imagen de la muestra. Un componente separado llamado dispositivo de conformación de frente de onda genera esta "escultura de luz" con luz de mayor intensidad para una iluminación más fuerte y la impulsa hacia la muestra para una segunda exposición.
Si la primera exposición produjo una imagen que fuera una representación perfecta de la muestra, las ondas de luz esculpidas a medida de la segunda exposición entrarían en la muestra en diferentes fases, pasar a través de la muestra, luego emergen como una hoja plana de luz, haciendo que la cámara no vea nada más que una imagen oscura.
"Esto es lo interesante:como que borramos la imagen de la muestra. No queremos ver casi nada. Anulamos las estructuras grandes para poder ver las más pequeñas con gran detalle, "Explicó Ideguchi.
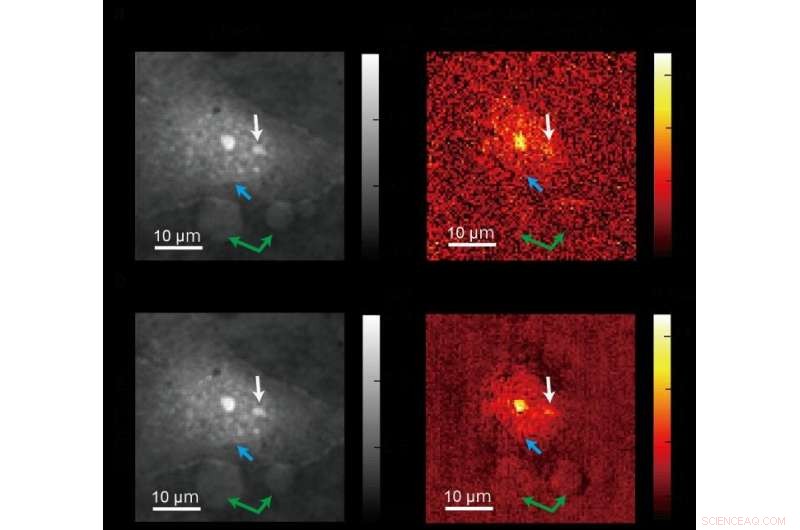
Una imagen estándar (arriba) tomada usando imágenes de fase cuantitativa convencional y una imagen más clara (abajo) producida usando un nuevo método de microscopía ADRIFT-QPI desarrollado por un equipo de investigación de la Universidad de Tokio. Las fotos de la izquierda son imágenes de la fase óptica y las imágenes de la derecha muestran el cambio de fase óptica debido a la absorción de luz del infrarrojo medio (específico molecular) principalmente por proteínas. La flecha azul apunta hacia el borde del núcleo, la flecha blanca apunta hacia los nucléolos (una subestructura dentro del núcleo), y las flechas verdes apuntan hacia otras partículas grandes. Crédito:Toda et al., CC-BY 4.0
En realidad, la primera exposición es imperfecta, por lo que las ondas de luz esculpidas emergen con sutiles desviaciones de fase.
La segunda exposición revela pequeñas diferencias de fase de luz que fueron "eliminadas" por diferencias más grandes en la primera exposición. Esta pequeña diferencia de fase de luz restante se puede medir con una mayor sensibilidad debido a la iluminación más fuerte utilizada en la segunda exposición.
El análisis por computadora adicional reconstruye una imagen final de la muestra con un rango dinámico expandido a partir de los dos resultados de medición. En demostraciones de prueba de concepto, Los investigadores estiman que ADRIFT-QPI produce imágenes con una sensibilidad siete veces mayor que las imágenes de fase cuantitativa convencionales.
Ideguchi dice que el verdadero beneficio de ADRIFT-QPI es su capacidad para ver partículas diminutas en el contexto de toda la célula viva sin necesidad de etiquetas o manchas.
"Por ejemplo, Se pueden detectar pequeñas señales de partículas a nanoescala como virus o partículas que se mueven dentro y fuera de una célula, que permite la observación simultánea de su comportamiento y el estado de la célula, "dijo Ideguchi.