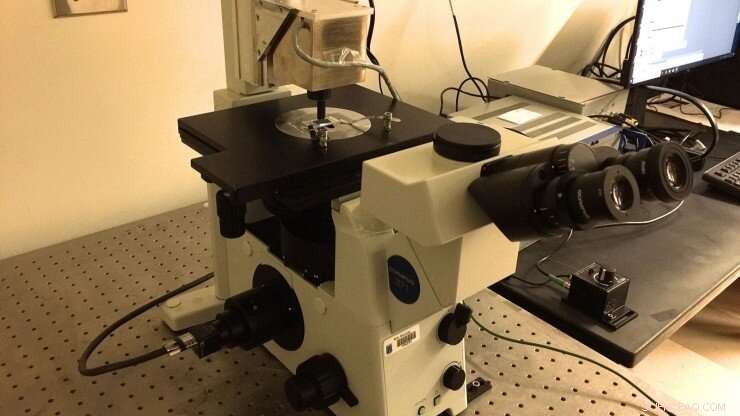
La nueva configuración de pinzas magnéticas del laboratorio Marszalek, el cual fue construido según especificaciones compartidas por el profesor Julio Fernández (Universidad de Columbia). Se obtiene una imagen de una cámara de microfluidos funcionalizada con “cepillos” de poliproteína utilizando un objetivo de aceite de inmersión que se alimenta a una cámara CMOS. Las perlas magnéticas se unen a las poliproteínas para ejercer fuerzas de piconewton sobre ellas ajustando la posición de los imanes de neodimio 52 permanentes. Los imanes se manipulan mediante un dispositivo PID colocado encima de la cámara. Crédito:Universidad de Duke
En términos de organización espacial, El ADN tiene poderes que rivalizan con Marie Kondo. Una hebra de ADN de dos metros de largo se pliega intrincadamente en un núcleo celular de solo 10 micrones de ancho. (Uno de los pelos de tu cabeza tiene un diámetro de 100 micrones, y no se puede ver nada más pequeño que eso sin un microscopio). Todo lo que necesita suceder bioquímicamente para que el ADN funcione depende del desempaquetado y desenrollado precisos de sus hebras desde ese espacio diminuto.
Pero el estudio del ADN y otras moléculas complejas a menudo se centra no en sus propiedades mecánicas sino en sus procesos químicos. señaló el profesor de ingeniería mecánica y ciencia de los materiales de Duke, Piotr Marszalek. Si bien la investigación bioquímica ha llevado a aplicaciones innovadoras como la clonación, terapia génica y elaboración de perfiles de expresión génica, Marszalek dijo que el intenso enfoque en un área única a veces ha eclipsado la importancia de la mecánica para comprender la relación entre la estructura molecular y la función.
Marszalek pertenece a una comunidad de investigadores que utilizan espectroscopia de fuerza de una sola molécula (SMFS) para estudiar la estructura molecular, y las fuerzas que estabilizan estas estructuras. En la actualidad, Hay tres enfoques principales para SMFS:microscopía de fuerza atómica (AFM), que escanea la superficie de una molécula con una sonda del tamaño de unos pocos átomos y es capaz de estirar mecánicamente estas moléculas; pinzas ópticas, que atraen partículas a través de láseres enfocados (y que le valieron a su inventor, Arthur Ashkin, Premio Nobel de Física); y pinzas magnéticas, cuya atracción es tan poderosa que Marszalek me advirtió que no los manejara, por miedo a que me pellizque la piel entre los cilindros magnéticos y me resulte imposible separarlos.
Cada enfoque permite a los investigadores capturar una sola molécula, como el ADN, o un poco de músculo u otra proteína, y estírelo lentamente para observar lo que sucede.
No solo se rompe por la mitad, como se podría esperar.
Las cadenas polipeptídicas se pliegan localmente, Marszalek explicó, de una manera que forma pequeños glóbulos. "Cuando inicialmente estiras una proteína, haces una estructura recta, ", dijo." Pero cuando tira más, todo comienza a relajarse. Puedes tirar y tirar sin romperte y en casos extremos, un dominio puede deshacerse y ofrecer una extensión adicional para protegerse ".
Marszalek enfatizó que esto no es noticia; en mayo de 1997, Casi simultáneamente se publicaron tres artículos sobre este tema, uno en Naturaleza (El equipo de Robert Simmons usó pinzas ópticas) y dos en Ciencias (El equipo de Carlos Bustamante también utilizó pinzas ópticas, mientras que el equipo de Herman Gaub utilizó AFM). Pero esos descubrimientos enseñaron a los investigadores mucho sobre cómo se construye el músculo, y reforzar la importancia de comprender la mecánica a la escala más pequeña.
Marszalek trabaja actualmente para comprender cómo las moléculas recuperan su forma y función una vez que se relaja la tensión ejercida sobre ellas. Tome luciferasa de luciérnaga, cuando esté correctamente doblada, esta proteína bioluminiscencia. Cuando pierde su estructura, se convierte en un simple polímero, incapaz de producir luz. Otras proteínas, en el mismo punto de colapso, Benefíciese de la ayuda de "enzimas acompañantes" que ayudan a recuperar su forma original. Como lo hacen exactamente, no esta claro, y aprender más sobre ese mecanismo podría dar una idea de cómo se curan nuestros cuerpos después del estrés físico.
Algunos de los colegas de Marszalek están trabajando en la mecánica de las infecciones bacterianas:cómo las bacterias como el estafilococo son capaces de detectar proteínas receptoras en las células y adherirse a ellas con tanta tenacidad que el torrente sanguíneo no puede eliminarlas. La fuerza de ese vínculo se midió con éxito en 2017 utilizando AFM, y descubrir cómo disolver los lazos podría ayudar en la lucha contra infecciones tan mortales.
Al final del verano de 2019, la National Science Foundation financió un taller SMFS que organizó Marszalek, junto con Andrés F. Oberhauser de la Rama Médica de la Universidad de Texas. Celebrada en Duke, el taller reunió a las luminarias que fueron pioneras en las técnicas SMFS hace décadas con investigadores jóvenes que se centran en las perspectivas futuras de la espectroscopia de fuerza. La intensa agenda de sesiones y mesas redondas se prolongó hasta bien entrada la noche todos los días, a medida que los participantes cubrieron los principales logros obtenidos por cada técnica, propuestas de direcciones futuras, y reflexionó sobre los obstáculos que impiden seguir avanzando.
También fue, como Marszalek había esperado, una reunión de intercambio de herramientas e ideas. Investigadores de la Universidad de Colorado-Boulder ofrecieron moléculas que pueden usarse como "manijas" para separar otras moléculas; un investigador de Johns Hopkins demostró cómo se pueden usar pinzas láser para capturar proteínas recién sintetizadas. El propio Marszalek se marchó con una nueva y brillante colaboración con la Universidad de Milwaukee, cuyos físicos tienen una gran experiencia con las pinzas magnéticas.
"La espectroscopia de fuerza de una sola molécula claramente ha alcanzado la mayoría de edad y ha producido muchos descubrimientos fundamentales en los campos de la mecanobiología y la mecanoquímica, ", dijo Marszalek." El entusiasmo por los enfoques SMFS está aumentando constantemente, pero hay desafíos por resolver, particularmente cuando se trata de explotar SMFS para estudiar las propiedades mecánicas y las fuerzas dentro de las células vivas. A medida que los investigadores desarrollan enfoques inteligentes para lograr ese objetivo, este tema por sí solo podría ser un tema de otro simposio emocionante ".