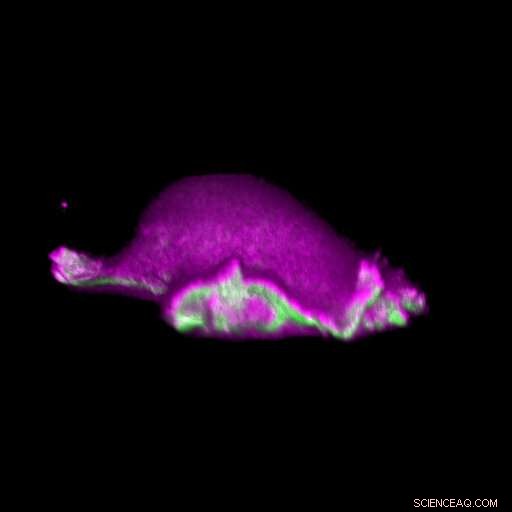
Una célula avanza:las proteínas I-BAR (rosadas) se acumulan en el lugar en el que se curva su lamelipodio. De este modo, la célula puede organizar localmente la proteína actina (verde) y generar un ciclo lamelipodial. Crédito:Isabell Begemann, Milos Galic
Cuando una celda individual se coloca en una superficie nivelada, no se queda quieto, pero comienza a moverse. Este fenómeno fue observado por el biólogo celular británico Michael Abercrombie ya en 1967. Desde entonces, Los investigadores se han esforzado por comprender cómo las células logran esta hazaña. Esto se sabe mucho:las células forman los llamados lamelipodios, protuberancias celulares que crecen y se contraen continuamente, para impulsarse hacia señales de señalización, como atrayentes químicos producidos y secretados por otras células. Cuando faltan tales señales externas, como en la observación de Abercrombie, las células comienzan a buscarlas activamente. Al hacerlo, utilizan patrones de búsqueda que también se pueden observar en tiburones, abejas o perros. Se mueven transitoriamente en una dirección, parada, menea en el lugar por un tiempo, y luego continúe moviéndose en otra dirección. Pero, ¿cómo mantienen las células la dirección de su movimiento durante un período de tiempo más largo?
Investigadores del Clúster de Excelencia Cells-in-Motion de la Universidad de Münster (Alemania) informan ahora de una respuesta a esta pregunta. Descubrieron que la geometría de la membrana puede desencadenar ciclos lamelipodiales posteriores:las fuerzas mecánicas provocan la generación de la curvatura de la membrana donde se congregan ciertas proteínas que reconocen esta geometría. Estas proteínas, Sucesivamente, permitir que la célula forme lamellipodia. "La curvatura, generado durante la retracción predetermina el crecimiento del siguiente ciclo lamelipodial. Así es como el mecanismo se reactiva constantemente, "explica el biólogo Dr. Milos Galic, líder del grupo de investigación junior en el Clúster de Excelencia, y autor principal del estudio. Cuando faltan señales externas, una célula no sólo se detiene y marca el tiempo, sino que se dirige momentáneamente en una dirección y patrulla eficazmente su entorno. El estudio ha sido publicado en la Física de la naturaleza diario.
El punto de partida del estudio fue una observación sorprendente realizada al analizar imágenes microscópicas. Los investigadores estaban investigando cómo las células formaban lamelipodia y, en consecuencia, cómo cambiaron el movimiento y la forma de las células. Descubrieron que la lamellipodia evolucionó en una amplia gama de tamaños y tenía una vida útil muy diferente.
"En los datos, no pudimos reconocer ningún patrón recurrente en el crecimiento y la contracción de lamellipodia, "dice el autor principal, el Dr. Isabell Begemann, bióloga que realizó el estudio como parte de su tesis doctoral. Los investigadores pudieron determinar que los sitios de extensión posterior de lamellipodia ocurrieron donde la membrana celular desarrolló una curvatura fuerte. Por lo tanto, plantearon la hipótesis de que un mecanismo vinculado a estas curvaturas puede determinar ciclos de movimiento continuo y, en consecuencia, persistencia del movimiento.
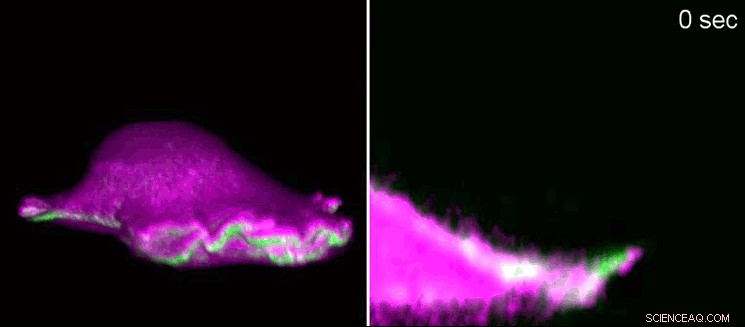
Un fibroblasto de un ratón avanza utilizando un "lamelipodio". A la izquierda, vista lateral en 3D, A la derecha, una sección transversal con zoom en el lamelipodio. Las proteínas I-BAR (rosa) se acumulan al comienzo del lamelipodio como resultado de la curvatura de la membrana celular. Como consecuencia, la célula puede organizar localmente la proteína actina (verde) y el lamelipodio vuelve a crecer. Usando microscopía de fluorescencia de hoja de luz de celosía, los investigadores mostraron las estructuras diminutas en 3D. Lamellipodia tiene una altura de 100 a 200 nanómetros. Crédito:Isabell Begemann, Milos Galic
Biólogos bioquímicos y físicos trabajaron en estrecha colaboración para investigar esta idea. Primero desarrollaron biosensores para etiquetar sitios muy curvados en la membrana celular, y los visualizó por diversos medios de microscopía de alta resolución. Para tal fin, conectaron moléculas fluorescentes con los llamados dominios I-BAR. Estas son regiones de proteínas en forma de plátano cuyo lado cargado positivamente se une a la membrana celular cargada negativamente, pero solo cuando la membrana está curva.
Aprovechando estos biosensores, los investigadores pudieron demostrar que las proteínas sensibles a la curvatura se acumulan en los sitios donde se contrae el lamelipodio. Una vez enriquecido, estas proteínas inducen fuerzas sobresalientes en la célula a través de la proteína actina, que desencadena el crecimiento del lamelipodio. En un próximo paso, los investigadores desarrollaron un modelo matemático que reconstituye el mecanismo y lo simularon en la computadora usando varias combinaciones de parámetros. La comparación de las predicciones derivadas del modelo matemático con datos complementarios de imágenes experimentales fortaleció aún más los resultados encontrados hasta ahora.
Los investigadores encontraron evidencia de la presencia del mecanismo de motilidad identificado en modelos de cultivo celular, por ejemplo, en células de tejido conectivo derivadas de ratones, en las células de los vasos sanguíneos humanos del cordón umbilical, y también en células inmunes humanas, es decir. un tipo de célula que de hecho se mueve libremente dentro del organismo. Finalmente, los investigadores también querían saber qué efectos tenía el mecanismo propuesto en el patrón de motilidad de una célula.
"Regulamos negativamente las proteínas I-BAR, permitiéndonos piratear el sistema de autoorganización de la célula, "dice Milos Galic. Sin el mecanismo, la celda todavía se las arregla para moverse, pero el área de búsqueda se vuelve sustancialmente más pequeña. Paralelamente a este mecanismo, hay otras maquinarias que se entrelazan, pero el mecanismo influye en el patrón de motilidad de una célula. Los resultados del estudio podrían, en el futuro, ayuda a responder preguntas fundamentales sobre procesos en organismos que involucran células que se mueven libremente.