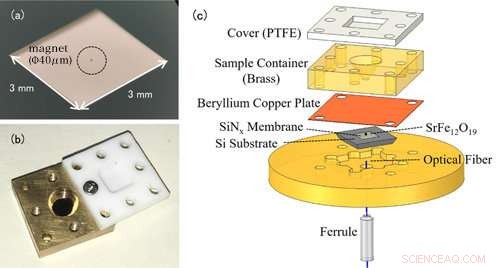
Figura 1:(a) Foto de una nanomembrana. La nanomembrana en sí es muy delgada (100 nm) por lo que parece transparente a simple vista. El elemento rodeado en el centro es un pequeño imán para la detección de EPR. (b) Foto de la celda de solución. El recipiente está cubierto con una tapa de teflón para evitar que la muestra de solución se evapore. (c) La configuración experimental de la espectroscopia EPR de detección de fuerza. La celda de solución que contiene la muestra de medición se coloca encima de la membrana con imanes adjuntos. Los cambios en la nanomembrana son detectados por la fibra óptica debajo de la membrana. Crédito:Universidad de Kobe
Los investigadores han desarrollado un nuevo método para analizar metaloproteínas con solo una pequeña muestra de líquido. Este avance fue logrado por un equipo de investigación dirigido por el profesor asociado Eiji Ohmichi y Tsubasa Okamoto en la Escuela de Graduados de Ciencias de la Universidad de Kobe. Los hallazgos fueron publicados el 28 de noviembre en Letras de física aplicada .
Las metaloproteínas (también conocidas como proteínas de unión a metales) desempeñan funciones vitales para el transporte y almacenamiento de oxígeno. transporte de electrones, oxidación y reducción. En muchos casos, los iones metálicos en estas proteínas son los centros activos para estas actividades, así que al identificar el estado exacto de estos iones, podemos comprender los mecanismos detrás de sus funciones.
Se puede utilizar un método experimental llamado resonancia paramagnética de electrones (EPR) para medir el estado de los iones electrónicos en las proteínas. Las técnicas de EPR efectivas requieren una cierta cantidad de volumen de muestra para mediciones sensibles. Sin embargo, muchas metaloproteínas son difíciles de aislar y refinar, por lo que los investigadores solo pueden obtener muestras pequeñas.
Las mediciones de EPR convencionales detectan las ondas electromagnéticas absorbidas por los iones metálicos. La característica notable de este estudio es el uso de un dispositivo con forma de trampolín llamado nanomembrana (figura 1 (a)). En EPR, el espín del electrón pasa a un estado de alta energía al absorber ondas electromagnéticas, pero al mismo tiempo, la dirección de giro se invierte, y las propiedades magnéticas de los iones metálicos también cambian. Antes del experimento, el equipo de investigación colocó pequeños imanes en la nanomembrana, por lo que los cambios en la fuerza de atracción entre los imanes y los iones metálicos se transforman en una fuerza sobre la nanomembrana, y se detecta esta señal EPR. Dado que la nanomembrana es muy delgada, solo 100 nm (=0,1 μm), podemos medir con sensibilidad pequeños cambios en la fuerza que acompañan a la absorción de EPR.
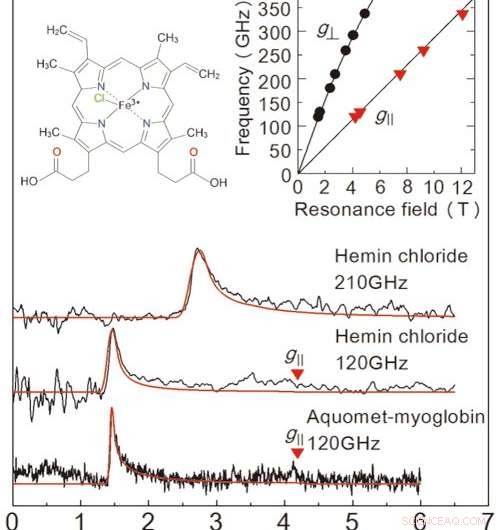
Figura 2:Resultados de las mediciones de EPR obtenidas en este estudio a partir de una muestra de solución congelada. Los dos diagramas superiores son para cloruro de hemina, y el gráfico de la parte inferior corresponde a la mioglobina. La línea roja es una señal proyectada de un simulador de valores. Las concentraciones de la solución y los volúmenes de muestra fueron 50 mM 、 2 μL para cloruro de hemina, y 8,8 mM 、 10 μL para mioglobina. Las mediciones se realizaron a 4,2 K. Al examinar las dos líneas del gráfico superior derecho, podemos determinar el estado exacto de los iones de hierro. El gráfico superior izquierdo muestra la estructura molecular del cloruro de hemina. Crédito:Universidad de Kobe
La muestra de solución se coloca en una celda de solución directamente encima de la membrana (figura 1 (b)). El volumen de la celda es de solo 50 μL (=0,05 cc), y el equipo agrega alrededor de 1-10μL (0.001-0.01 cc) de solución para la medición. Para evitar que la solución se evapore, la celda está cubierta con una tapa de resina. En este método, la nanomembrana delgada y frágil es independiente de la celda de solución, facilitando el cambio de muestras (figura 1 (c)).
Para evaluar el rendimiento de esta configuración, el equipo llevó a cabo la medición de EPR en alta frecuencia (más de 0,1 THz) para una proteína que contiene hierro llamada mioglobina y su complejo modelo cloruro de hemina (figura 2). El equipo logró detectar señales EPR en una frecuencia de onda amplia (0,1-0,35 THz) para una concentración de 50 mM. Solución de cloruro de hemina de 2μL. También observaron una señal EPR característica para un 8.8 mM, Muestra de 10μL de solución de mioglobina. Una gran ventaja de este método es la capacidad de medir en un amplio rango de frecuencias, haciéndolo aplicable para metaloproteínas con una variedad de propiedades magnéticas.
El profesor Ohmichi comenta:"Este nuevo método permite determinar a un nivel detallado el estado de los iones metálicos en una pequeña cantidad de solución de metaloproteínas. Es posible que podamos aplicar el método a metaloproteínas que antes no se podían medir. Por ejemplo, , en nuestro metabolismo, una metaloproteína llamada peroxidasa juega un papel crucial al convertir el peróxido de hidrógeno en agua, haciéndolo inofensivo, pero los detalles del mecanismo de este proceso reactivo aún no están claros. Los resultados de este estudio pueden potencialmente aplicarse como un método de análisis líder para arrojar luz sobre este tipo de fenómeno vital ".