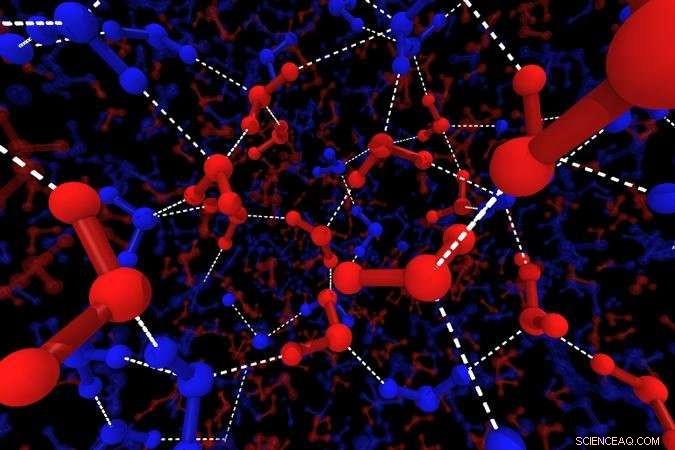
Ilustración de las estructuras locales del agua. Las líneas azules muestran las moléculas de H2O de estructura tetraédrica, las líneas rojas muestran moléculas de H2O de estructura desordenada. Las bolas grandes muestran átomos de oxígeno, las bolas pequeñas muestran hidrógeno y las líneas blancas punteadas representan enlaces de hidrógeno. Crédito:2018 Hajime Tanaka, Instituto de Ciencias Industriales, La universidad de tokio
Un equipo de investigación japonés dirigido por la Universidad de Tokio investigó la transición del agua de frágil a fuerte. A diferencia de la mayoría de los líquidos, cuando el agua se enfría, la tasa de aumento de su viscosidad alcanza un máximo a una cierta temperatura baja. El equipo demostró que modelar el agua como una mezcla de dos estados dependiente de la temperatura (agua rápida desordenada y agua lenta ordenada localmente) explicaba la transición de frágil a fuerte y evitaba las predicciones erróneas de teorías anteriores basadas en el comportamiento vítreo.
El agua es extraña en muchos sentidos. Algunas de sus peculiaridades químicas son familiares, como expandirse cuando se congela hasta convertirse en hielo. Una curiosidad menos conocida, que comparte con algunos otros líquidos, es la transición de frágil a fuerte. Explicando este comportamiento, que se relaciona con cómo fluye el agua fría, ha sido durante mucho tiempo una fuente de debate. Ahora, Los investigadores de Tokio han presentado una explicación convincente.
Cuando los líquidos se enfrían, su dinámica se ralentiza y se vuelven viscosos. Para la mayoría de los líquidos, la velocidad de desaceleración es constante en función de la temperatura y se conocen como líquidos fuertes. Para líquidos frágiles, sin embargo, la tasa aumenta continuamente a medida que desciende la temperatura. El agua es inusual en este sentido:es frágil a temperatura ambiente, pero fuerte a bajas temperaturas, donde su tasa de aumento de la viscosidad alcanza un pico.
Esta transición de frágil a fuerte es esquiva, ocurriendo solo en el régimen sobreenfriado, por debajo del punto de congelación habitual del agua. Los primeros modelos intentaron vincularlo a la dinámica vítrea, ya que se sabe que el agua sobreenfriada es un formador de vidrio. Sin embargo, un equipo dirigido por el Instituto de Ciencias Industriales (IIS) de la Universidad de Tokio propone una teoría de dos estados, en efecto, modelando el agua como una mezcla de dos líquidos coexistentes.
Matemáticamente, la distinción fuerte / frágil se basa en la ley de Arrhenius para procesos dinámicos:los líquidos fuertes obedecen esta ley, pero para los frágiles, el rápido aumento de la viscosidad es super-Arrhenius. Como se informó en la revista PNAS , el equipo de IIS enmendó este punto de vista al considerar que el agua consta de dos estados, denominados "rápidos" y "lentos, "que son estructuralmente diferentes, pero ambos obedecen a la dinámica de Arrhenius.
"Simulamos el agua por dinámica molecular y buscamos patrones estructurales, "explica el coautor del estudio Rui Shi". Las moléculas de H2O siempre se ensamblan en tetraedros, pero vimos que algunas de estas estructuras locales estaban muy ordenadas, otros menos. "Los estados desordenados corresponden a agua rápida, y dominar a alta temperatura, mientras que el estado lento bien ordenado se hace cargo a medida que la muestra se enfría.
Crucialmente, las ecuaciones derivadas del modelo de dos estados predicen con éxito el cruce de frágil a fuerte. Esto sucede muy por encima del punto de transición vítrea; el comportamiento vítreo parece ser una pista falsa en lo que respecta a este problema. El hecho de que el agua rápida tenga Arrhenius, en lugar de poder-ley, La dinámica también resuelve predicciones erróneas basadas en intentos anteriores de vincular la fragilidad del agua con ciertos aspectos de su diagrama de fases.
"El agua frágil puede ser una ilusión. La aparente transición es un artefacto del equilibrio dependiente de la temperatura de dos estados líquidos fuertes, "dice el autor principal Hajime Tanaka." La presencia de dos estados refleja la tendencia del agua a formar estructuras locales, que es más fácil a baja temperatura. De hecho, otros líquidos con una transición de frágil a fuerte, como la sílice, también mostrar pedidos locales. Proponemos que esto, en lugar de cualquier comportamiento vidrioso, es lo que los distingue de los verdaderos líquidos frágiles ".