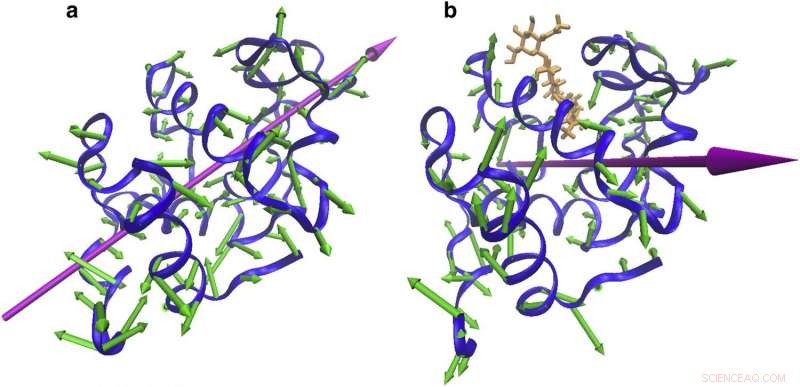
Cambios en la dirección vibratoria con encuadernación. Vibraciones de la proteína que indican (a) un movimiento de sujeción alrededor del sitio de unión a 55 cm \ sim 1 del NMA de CEWL libre y (b) una torsión alrededor del sitio de unión. Crédito:Reimpreso con permiso de Biophysical Journal.
En todo momento dentro del cuerpo humano, se está realizando una danza cuidadosamente coreografiada.
Las proteínas sacuden sus cuerpos y agitan sus extremidades, todo con el objetivo de optimizar su interacción con otras moléculas, incluyendo otras proteínas. Estos pequeños movimientos llamadas vibraciones, permitir que las moléculas cambien de forma rápidamente para unirse entre sí, lo que a su vez facilita tareas como absorber oxígeno y reparar células.
La eficiencia del cuerpo para realizar estas funciones depende de qué tan bien puedan interactuar las proteínas.
Pero, ¿qué hace que una proteína sea mejor pretendiente que otra?
Un nuevo estudio arroja luz sobre esta cuestión, mostrando que en este noviazgo biológico, los movimientos de baile importan.
"En el pasado, la investigación sobre vibraciones de proteínas se centró mucho en la energía de esas vibraciones, "dice la científica principal Andrea Markelz, Doctor, profesor de física en la Facultad de Artes y Ciencias de la Universidad de Buffalo. "Pero lo que encontramos es que la dirección del movimiento parece ser más importante. La dirección del movimiento, la dirección en la que se mueven las diferentes partes de la proteína, realmente puede determinar qué tan bien una proteína realiza su función biológica".
Los hallazgos ayudan a sentar las bases para el desarrollo de fármacos dirigidos a las vibraciones moleculares. Tales productos farmacéuticos impedirían que las proteínas realicen tareas que contribuyen a la enfermedad.
"Realizamos la investigación utilizando una nueva técnica que desarrollamos llamada microscopía anisotrópica de terahercios (ATM), que revela cómo la naturaleza explota los movimientos de las proteínas para mejorar la eficiencia. Luego podemos optimizar estos movimientos para la medicina y la biotecnología, "dice la primera autora Katherine Niessen, Candidato a Doctorado en Física por la UB.
La investigación, publicado el 14 de marzo en Revista biofísica , fue realizado por UB, la Universidad de Perugia en Italia, y el Instituto de Investigación Médica Hauptman-Woodward. Fue financiado por la National Science Foundation (NSF).
¿Foxtrot o tango?
El estudio se centró en la lisozima de la clara de huevo de gallina, una proteína que se encuentra en las claras de huevo.
Como primer paso en su proyecto, los científicos compararon las vibraciones regulares de la lisozima con las vibraciones de la lisozima cuando estaba unida a una molécula cuya presencia impedía que la proteína realizara sus funciones biológicas habituales.
Lo que vieron los científicos fue que las lisozimas libres e inhibidas vibraban a energías similares, pero con distintas direcciones de movimiento:la lisozima libre revoloteó con una acción de aleteo similar a una bisagra, como las alas de una mariposa, mientras que la lisozima inhibida se movió en un patrón más parecido a una tijera.
"El resultado fue un cambio fundamental de la visión convencional. Las vibraciones cambiaron su dirección, incluso cuando la energía de los movimientos se mantuvo igual, "Dice Markelz. (Ella agrega que como analogía, esto es similar a dos personas que realizan bailes diferentes:el foxtrot y el tango, por ejemplo, pero ejerciendo la misma cantidad de energía).
La misma dinámica surgió cuando el equipo comparó la lisozima regular con una lisozima de clara de huevo de gallina mutante que era más eficaz para realizar su trabajo. Las lisozimas mutantes y normales tenían las mismas energías vibratorias, pero diferentes direcciones vibratorias.
Un instrumento llave en mano para medir vibraciones
La investigación sobre vibraciones moleculares podría abrir nuevas vías para el desarrollo de fármacos y la recolección de energía artificial (las vibraciones pueden explicar por qué la fotosíntesis es tan eficiente). Pero históricamente los diminutos pulsos y palpitaciones dentro de las proteínas han sido muy difíciles de estudiar.
Markelz espera cambiar eso desarrollando un instrumento llave en mano que los científicos de todo el mundo puedan usar para investigar las vibraciones.
Para estudiar la lisozima de la clara de huevo de gallina, su equipo empleó la técnica ATM que su grupo de investigación desarrolló internamente. A diferencia de otros métodos utilizados para investigar las vibraciones de proteínas, ATM permite a los científicos observar no solo energías vibratorias, sino también la dirección de los movimientos.
La NSF recientemente otorgó a Markelz casi $ 400, 000 subvención para comercializar un instrumento ATM fácil de usar, lo que ampliaría la capacidad de la comunidad científica para explorar las vibraciones moleculares. El dispositivo representaría un gran avance sobre otros métodos existentes, que proporcionan solo una visión general aproximada de las vibraciones y requieren entornos extremadamente secos y fríos e instalaciones costosas, Dice Markelz.