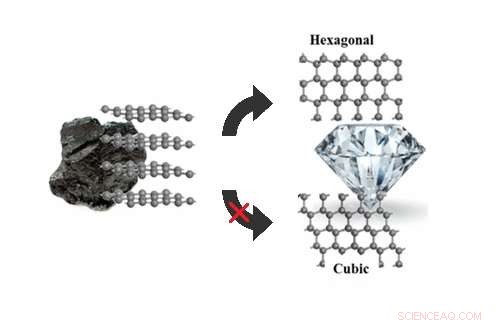
Las simulaciones de caminar sobre superficies estocásticas pueden explicar por qué el grafito se convierte en hexagonal, no cúbico, diamante bajo presiones de 5-20 gigapascales. Crédito:Xie et al. © 2017 Sociedad Química Estadounidense
(Phys.org) —Los investigadores finalmente han respondido una pregunta que ha eludido a los científicos durante años:cuando se exponen a presiones moderadamente altas, ¿Por qué el grafito se convierte en un diamante hexagonal (también llamado lonsdaleita) y no en el diamante cúbico más familiar? como predice la teoría?
La respuesta se reduce en gran medida a una cuestión de velocidad, o en términos de química, la cinética de la reacción. Usando un nuevo tipo de simulación, los investigadores identificaron las vías de menor energía en la transición del grafito al diamante y encontraron que la transición al diamante hexagonal es aproximadamente 40 veces más rápida que la transición al diamante cúbico. Incluso cuando el diamante cúbico comienza a formarse, todavía se mezcla una gran cantidad de diamante hexagonal.
Los investigadores, Yao-Ping Xie, Xiao-Jie Zhang, y Zhi-Pan Liu en la Universidad Fudan y la Universidad de Shanghai en Shanghai, Porcelana, han publicado su estudio sobre las nuevas simulaciones de la transición de grafito a diamante en un número reciente de la Revista de la Sociedad Química Estadounidense .
"Este trabajo resuelve el antiguo rompecabezas de por qué el diamante hexagonal se produce preferentemente a partir de grafito en lugar del diamante cúbico al inicio de la formación del diamante, "Liu dijo Phys.org . "Teniendo en cuenta que el grafito al diamante es un prototipo de transición de sólido a sólido, el conocimiento aprendido de este trabajo debería beneficiar enormemente la comprensión de la física y la química de sólidos de alta presión ".
Grafito, diamante hexagonal, y el diamante cúbico son todos alótropos de carbono, lo que significa que están hechos de átomos de carbono que están dispuestos de diferentes maneras. El grafito consta de capas apiladas de grafeno, cuyos átomos están dispuestos en una red en forma de panal. Dado que los átomos de carbono del grafeno no están completamente unidos, el grafeno es suave y se descascara fácilmente, haciéndolo ideal para usar como mina de lápiz.
Ambos tipos de diamantes, por otra parte, constan de átomos de carbono que tienen el máximo de cuatro enlaces, lo que explica por qué el diamante es tan duro. En diamante cúbico (del tipo que se encuentra típicamente en joyería), las capas están todas orientadas en la misma dirección. En diamante hexagonal, las capas se orientan alternativamente, dándole una simetría hexagonal.
Bajo altas presiones de más de 20 gigapascales (casi 200, 000 veces la presión atmosférica), la teoría y el experimento coinciden en que el grafito se convierte en un diamante cúbico, con un diamante hexagonal mezclado. Pero bajo presiones de menos de 20 gigapascales, Las simulaciones siempre han predicho que el diamante cúbico debería ser el producto preferido, en contraste con los experimentos.
Estas simulaciones se basan en la predicción de que, a estas presiones, se requiere menos energía para formar el núcleo de nucleación de diamante cúbico, o núcleo — el punto de partida del crecimiento del diamante — que para formar el núcleo hexagonal del diamante. Dado que la formación de este núcleo es el paso que más energía consume de todo el proceso, de ello se deduce que la formación de diamantes cúbicos debería ser termodinámicamente más favorable que la de los diamantes hexagonales.
Pero un gran inconveniente de estas simulaciones es que no tienen en cuenta las interfaces entre el grafito y los núcleos de diamante:un desajuste de celosía entre las dos superficies puede inducir una energía de deformación que puede interferir con la estabilidad del diamante en crecimiento.
Usando una simulación novedosa llamada caminar sobre superficies estocásticas, Los investigadores del nuevo estudio pudieron explorar más a fondo todas las posibles interfaces e identificar siete de ellas que corresponden a las estructuras intermedias de menor energía en la transición de grafito a diamante.
En general, Los resultados muestran que la interfaz entre el grafito y el núcleo de diamante hexagonal es menos tensa y más estable que la interfaz con el núcleo de diamante cúbico. Tener en cuenta la estabilidad de estas interfaces puede finalmente explicar por qué el diamante hexagonal se forma mucho más fácil y rápidamente que el diamante cúbico a presiones moderadas.
Los investigadores agregaron que, aunque el diamante cúbico puede parecer más deseable que el diamante hexagonal para la persona promedio, Ambos materiales tienen sus ventajas.
"Si bien el diamante cúbico es familiar en la vida cotidiana y es un material muy útil, El diamante hexagonal también podría ser muy útil, "Dijo Liu." Por ejemplo, la teoría predijo que era incluso más duro que el diamante cúbico. Mientras que el diamante hexagonal (lonsdaleita) se puede encontrar en meteoritos, la producción de grandes cristales hexagonales de diamante no se ha logrado en el experimento. Por lo tanto, uno esperaría que los grandes cristales de diamantes hexagonales, si se produce, sería incluso más precioso que el diamante cúbico ".
En el futuro, Los investigadores planean mejorar aún más las simulaciones mediante la incorporación de técnicas de redes neuronales y el uso de big data.
© 2017 Phys.org