Un gran número de aplicaciones en la industria química dependen de las moléculas NADH o NADPH como combustible. Un equipo dirigido por el profesor Dirk Tischler, jefe del grupo de trabajo de Biotecnología Microbiana de la Universidad del Ruhr en Bochum, utilizó un biocatalizador para estudiar en detalle su producción.
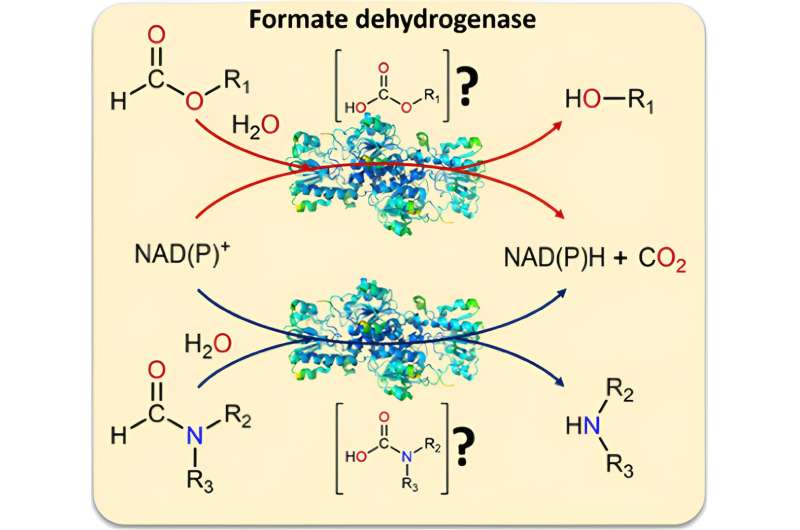
Los investigadores demostraron que, además del formiato, el biocatalizador formiato deshidrogenasa también puede convertir formamidas. Esto significa, por un lado, que la enzima también puede escindir el enlace C-N, difícil de romper. Por otro lado, las formamidas son un disolvente común.
"Esto abre posibilidades completamente nuevas para reacciones de NADH poco solubles y reacciones dependientes de NADPH", afirma Tischler.
Los investigadores publicaron sus hallazgos en la revista ACS Catalysis. el 26 de enero de 2024.
La formiato deshidrogenasa se utiliza en procesos biocatalíticos para hacer que los electrones estén disponibles como combustible para reacciones posteriores eliminándolos de un sustrato. En las aplicaciones actuales, el sustrato es NAD+ y el producto es NADH. El producto de desecho es CO2 .
"Esto es bueno en este caso, ya que se escapa en forma de gas y, por lo tanto, evita que se produzca la reacción deseada a la inversa", explica Tischler.
Como la variante NADPH (con un grupo fosfato más) a menudo se requiere como producto, su equipo creó mutantes del biocatalizador que convierte NADP+ en el producto deseado.

¿Qué pasa si el catalizador también rompe el enlace C-N?
Mientras trabajaban en la formiato deshidrogenasa, los investigadores se dieron cuenta de que se sabía poco sobre materiales de partida alternativos para el biocatalizador. "Estudiamos diferentes sustratos posibles (derivados de formiato) y descubrimos que al convertirlos en el biocatalizador siempre se rompe un enlace C-O", explica Tischler. "Esto nos dio una idea:¿Qué pasaría si la enzima también pudiera escindir enlaces C-N, una tarea tradicionalmente difícil de resolver?"
Otras pruebas demostraron que el biocatalizador es realmente capaz de hacer esto:también puede convertir formamidas, derivados del formiato, con un compuesto adicional para formar nitrógeno, como material de partida. Dado que las formamidas son disolventes comunes y económicos, sirven como disolvente y sustrato en esta reacción. También es posible proporcionar NADH y NADPH en esta constelación. CO2 También se produce como producto de desecho en estas reacciones y, al escapar, evita que las reacciones retrocedan.
"Esta reacción nunca se había descrito antes", afirma Tischler. Su equipo demostró que el uso de formamidas como fuente de electrones para la formación de NADPH puede lograr resultados equivalentes o incluso ligeramente mejores en comparación con el sistema convencional con formiato.
"Esto abre posibilidades completamente nuevas, ya que nuestros mutantes más estables siguen activos hasta en un 40% del volumen de formamidas", afirma el investigador.
Más información: Artur Maier et al, Desbloqueo de la diversidad catalítica de una formiato deshidrogenasa:actividad de formamida para la regeneración de NADPH y suministro de aminas para la aminación reductiva asimétrica, Catálisis ACS (2024). DOI:10.1021/acscatal.3c05409
Información de la revista: Catálisis ACS
Proporcionado por Ruhr-Universitaet-Bochum