Crédito:Angewandte Chemie (2022). DOI:10.1002/ange.202117849
La β-N-acetilglucosamina ligada a O (O-GlcNAcylation), una importante modificación postraduccional (PTM) de proteínas, está involucrada en varias funciones biológicas.
La modificación reversible de O-GlcNAc confiere funciones de proteína on-off durante los procesos biológicos. Las aberraciones de O-GlcNAcylation están estrechamente asociadas con muchas enfermedades metabólicas junto con la invasión y metástasis de varios tumores.
Recientemente, un equipo de investigación dirigido por el Prof. Ye Mingliang y el Prof. Qin Hongqiang del Instituto de Física Química de Dalian (DICP) de la Academia de Ciencias de China (CAS), en colaboración con el Prof. Huang Wei del Instituto de Materia Médica de Shanghai de CAS, desarrolló una nueva estrategia de marcaje quimioenzimático reversible de glicopéptidos O-GlcNAc, que permitió un análisis en profundidad de la proteína O-GlcNAcylation.
Sus hallazgos fueron publicados en Angewandte Chemie el 14 de marzo.
Para permitir el análisis de todo el proteoma de la O-GlcNAcylation, es esencial enriquecer selectivamente los glicopéptidos de los digeridos de muestras complejas.
Muchos investigadores han buscado el enriquecimiento de los péptidos O-GlcNAcylated antes del análisis por cromatografía líquida con espectrometría de masas en tándem (LC-MS/MS). Sin embargo, la mayoría de los enfoques tienen una afinidad de unión débil o etiquetas voluminosas, que interfieren con el enriquecimiento y la identificación de los péptidos O-GlcNAcylated.
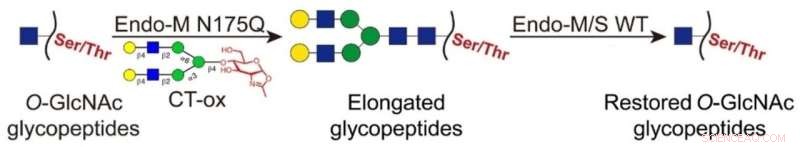
En esta estrategia recientemente desarrollada, los restos de O-GlcNAc se ligaron con N-glicanos largos utilizando un mutante Endo-M, lo que permitió el enriquecimiento de los glucopéptidos marcados mediante cromatografía líquida de interacción hidrófila (HILIC). Luego, los glucanos adheridos a los glucopéptidos enriquecidos se eliminaron mediante Endo-M/S de tipo salvaje para restaurar el resto O-GlcNAc.
En comparación con el etiquetado quimioenzimático clásico, este enfoque permitió la identificación sin etiquetas y eliminó la interferencia de las etiquetas voluminosas en la detección de glicopéptidos.
Además, mediante el uso de este método, los investigadores identificaron 657 glucositos O-GlcNAc potenciales a partir de solo 0,4 mg de proteínas nucleares de células HeLa, que solo se necesitaban 1/10 de las muestras de proteínas para un análisis comparable de O-GlcNAcylation, lo que indica la alta sensibilidad de este método.
En total, identificaron 1414 glucositos a partir de solo 1,1 mg de muestras de proteínas, y el 45 % de ellos no se incluyeron en O-GlcNAcAltas de todas las muestras humanas en los últimos 35 años, lo que mejoró la cobertura del análisis de la proteína O-GlcNAcylation.
"Esta estrategia de enriquecimiento sin etiquetas representa una vía única para el análisis de todo el proteoma de la O-GlcNAcylation y promueve los estudios del mecanismo", dijo el Prof. Ye. Los mecanismos moleculares del Alzheimer