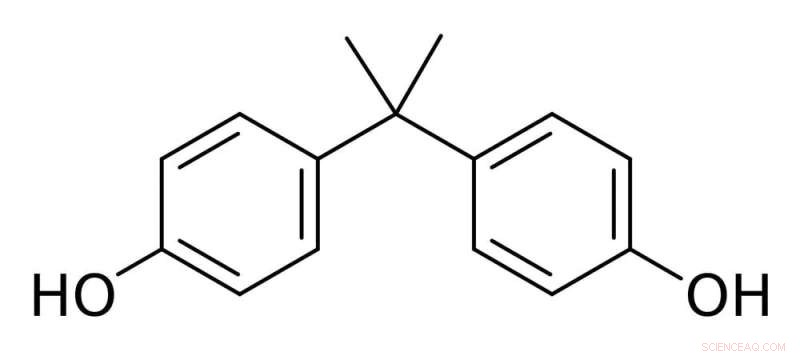
El bisfenol A está hecho de dos anillos de carbono con pequeños grupos de alcohol unidos y se usa para producir plásticos transparentes y resistentes. Crédito:Darkness3560/Wikimedia Commons
El bisfenol A, o BPA, es un químico ampliamente utilizado para fabricar plásticos duros y transparentes. Es un disruptor endocrino que se ha relacionado con muchos efectos negativos para la salud, incluidas las enfermedades cardiovasculares y la diabetes. En 2013, el gobierno de EE. UU. prohibió su uso en productos para bebés que entran en contacto con alimentos, como biberones o envases de fórmula infantil.
En ese momento, la Administración de Drogas y Alimentos de los EE. UU. concluyó que cierta exposición era segura para los adultos. Pero otras agencias de salud, incluida la Autoridad Europea de Seguridad Alimentaria, han concluido que los niveles de BPA que la FDA considera seguros también pueden tener efectos adversos para la salud de los adultos.
A principios de junio de 2022, la FDA señaló que está reconsiderando qué cantidad de exposición al BPA es segura para los adultos y anunció que reconsideraría su guía sobre el uso de BPA en plásticos que entran en contacto con alimentos.
Como químico de polímeros sintéticos, pienso mucho en cómo diseñar nuevos polímeros, con un enfoque particular en cómo hacerlo de manera sostenible. Es natural preguntarse por qué las empresas simplemente no reemplazan el BPA con otro químico si la salud es una preocupación tan grande. El secreto de lo que hace que el BPA sea un ingrediente tan irremplazable en los plásticos es lo mismo que conduce a sus riesgos para la salud:la estructura química de la molécula.
¿Qué es el BPA?
El BPA es una molécula pequeña formada por dos anillos de carbono con un oxígeno y un hidrógeno unidos en cada extremo. El BPA puede reaccionar con otras moléculas a base de carbono para formar cadenas largas, con las moléculas de BPA unidas por pequeños enlaces químicos.
Casi todo el BPA que se produce en el mundo se usa para fabricar plásticos, principalmente un tipo específico llamado policarbonato. Los policarbonatos derivados de BPA son transparentes, increíblemente resistentes, livianos y no comienzan a derretirse ni a perder su integridad estructural hasta que alcanzan temperaturas muy altas. Estas propiedades hacen que los policarbonatos sean excelentes para su uso en todo, desde lentes de anteojos hasta botellas de agua.
Se trata de la estructura
En química, la estructura significa todo. Las razones por las que diferentes materiales tienen diferentes propiedades se deben a su estructura química.
Los polímeros de BPA son rígidos porque los anillos de carbono de las moléculas de BPA son rígidos. Compare esto con el polietileno, el material delgado y flexible que se usa para fabricar bolsas de plástico. Las largas cadenas de moléculas repetitivas que forman el polietileno son muy flexibles. Por lo tanto, los plásticos que producen también son muy flexibles.
¿Cómo se filtran los BPA del plástico?
Cuando se fabrican plásticos de BPA, casi todas las moléculas individuales de BPA se unen químicamente al plástico. Por lo tanto, la mayor parte del BPA que se filtra de los recipientes de comida o de las botellas de agua se debe a que el plástico se descompone lentamente.
Cuando los policarbonatos de BPA se exponen al agua y al calor, por ejemplo, cuando coloca una botella de plástico en su lavavajillas, los enlaces químicos que unen estas moléculas de BPA pueden romperse en un proceso conocido como hidrólisis. Debido a su estructura única, los policarbonatos BPA son generalmente más susceptibles a la hidrólisis que los plásticos como el polietileno.
La hidrólisis descompone el plástico a nivel químico y esto libera una pequeña cantidad de moléculas de BPA al medio ambiente. En un estudio, los investigadores encontraron que el proceso de lavado de una botella de policarbonato filtraba de 0,2 a 0,3 miligramos de BPA en cada litro de agua. Por contexto, esto es cientos de veces menos concentrado que los niveles de calcio y sodio en el agua potable.
La búsqueda de un sustituto del BPA
El BPA es un disruptor endocrino, lo que significa que altera el funcionamiento de las hormonas en el cuerpo. Dados los efectos negativos para la salud del consumo de BPA y el hecho de que se descompone cuando se expone al agua, los químicos han estado buscando sustitutos durante años.
Una preocupación importante con el diseño de nuevos plásticos es que cambiar el BPA por otra molécula puede no eliminar los efectos negativos para la salud. Así como la estructura química del BPA determina las propiedades del material, la estructura también es lo que desencadena los efectos biológicos negativos. Los disruptores endocrinos como el BPA, debido a sus estructuras similares a las hormonas naturales, pueden unirse y activar los receptores endocrinos.
Las investigaciones han demostrado que los reemplazos químicos estructuralmente similares, como el bisfenol F, producen efectos en la salud similares a los del BPA.
Tampoco es fácil intercambiar una nueva molécula que tenga una estructura química diferente porque el plástico perderá las características deseables de los policarbonatos BPA. Pero hay algunas nuevas investigaciones prometedoras. Una vía de investigación se centra en la fabricación de policarbonatos mediante la reacción de moléculas rígidas de base biológica con gas de dióxido de carbono.
Los policarbonatos son una parte omnipresente de la vida moderna. A medida que los investigadores desarrollan nuevos materiales, es importante considerar no solo los riesgos para la salud, como lo está haciendo la EPA con el BPA, sino también los efectos ambientales.
Este artículo se vuelve a publicar de The Conversation bajo una licencia Creative Commons. Lea el artículo original. Los científicos hacen que el plástico sea más degradable bajo la luz ultravioleta
