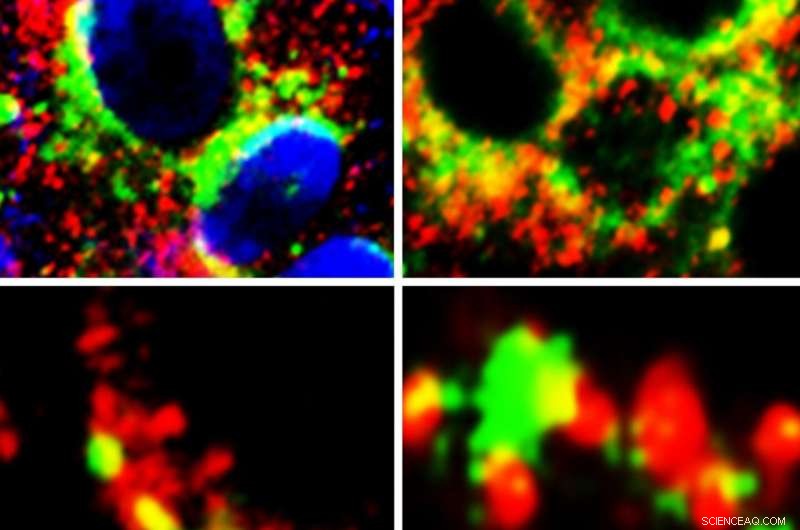
Células que muestran una gran proximidad (amarillo) de GRP78 (verde) con la proteína Spike de SARS-Cov-2 (rojo) (paneles de la izquierda) y ACE2 (rojo) (paneles de la derecha). Crédito:Autor principal Anthony Carlos, Doctor
El rápido desarrollo de vacunas ha proporcionado una herramienta vital para combatir la propagación del mortal virus SARS-CoV-2. pero los desafíos para alcanzar la inmunidad colectiva planteados por el aumento de nuevas mutaciones y la incapacidad de las personas inmunodeprimidas para desarrollar una respuesta inmunitaria eficaz después de la vacunación apuntan a la necesidad de soluciones adicionales para maximizar la protección.
Un nuevo estudio de la USC publicado en el Revista de química biológica revela cómo las terapias dirigidas a una chaperona molecular llamada GRP78 podrían ofrecer protección adicional contra COVID-19 y otros coronavirus que surjan en el futuro.
Las chaperonas como GRP78 son moléculas que ayudan a regular el correcto plegamiento de proteínas, especialmente cuando una célula está bajo estrés. Pero en algunos casos, los virus pueden secuestrar estas chaperonas para infectar las células objetivo, donde se reproducen y se propagan. GRP78 ha estado implicado en la propagación de otros virus graves, como el ébola y el zika.
GRP78 juega más de un papel en COVID-19
Si bien los estudios han demostrado que el SARS-CoV-2, el virus que causa COVID-19, infecta las células al unirse con los receptores ACE2 en su superficie, Investigadores de la Escuela de Medicina Keck de la USC examinaron si GRP78 también tiene un papel.
Descubrieron que GRP78 sirve como correceptor y agente estabilizador entre ACE2 y SARS-CoV-2, mejorando el reconocimiento de la proteína de pico del virus y permitiendo una entrada viral más eficiente en las células huésped.
Este estudio proporciona la primera evidencia experimental que respalda las predicciones de modelos informáticos, demostrando que GRP78 se une a la proteína Spike del SARS-CoV-2 en las células. Curiosamente, el modelado por computadora muestra además que las variantes de COVID-19 que son más infecciosas se unen más fuerte a GRP78.
Adicionalmente, el equipo de investigación descubrió que GRP78 también se une y actúa como un regulador de ACE2, llevando la proteína a la superficie celular, que ofrece al SARS-CoV-2 más puntos para unirse e infectar células.
"Nuestro estudio revela que la terapia dirigida a GRP78 podría ser más eficaz para proteger y tratar a las personas que contraen COVID-19 que las vacunas solas, particularmente cuando se trata de personas que no pueden recibir la vacuna y variantes que podrían eludir la protección de la vacuna pero que aún dependen de GRP78 para la entrada y producción, "dijo la autora principal Amy S. Lee, Doctor., Judy y Larry Freeman Cátedra de investigación en ciencias básicas y profesora del departamento de bioquímica y medicina molecular de la Escuela de Medicina Keck de la USC.
Cómo el SARS-CoV-2 secuestra GRP78
El trabajo de GRP78 como molécula chaperona es doblar las proteínas en el retículo endoplásmico (RE), que es una fábrica de producción de proteínas. Sobre el estrés, incluido el estrés causado por la infección por SARS-CoV-2, El GRP78 se envía a la superficie de la celda. Allí, Facilita la unión entre ACE2 y la proteína Spike de SARS-CoV-2, conduciendo a una entrada viral mejorada. Una vez dentro de la celda, Se sabe que los virus secuestran la maquinaria de plegado de proteínas ER, del cual GRP78 es un actor clave, para producir más proteínas virales.
Este proceso puede intensificarse en células sometidas a estrés por otras enfermedades como la diabetes o el cáncer. lo cual puede ser una de las razones por las que las personas que tienen condiciones de salud subyacentes son más susceptibles a la infección por SARS-CoV-2.
Para investigar el papel de GRP78 en la infección por SARS-CoV-2, los investigadores trataron las células epiteliales del pulmón con un anticuerpo monoclonal humanizado (hMAb159), conocido por eliminar GRP78 de la superficie celular sin efectos adversos en modelos de ratón. La intervención eliminó GRP78 y redujo ACE2 en la superficie celular, disminuyendo el número de objetivos a los que podría adherirse el SARS-CoV-2.
Estos hallazgos llevaron a los investigadores a concluir que las intervenciones, como hMAb159, para eliminar la superficie celular, el GRP78 podría reducir la infección por SARS-CoV-2 e inhibir la propagación y la gravedad de COVID-19 en personas infectadas.
Potencial de tratamiento dirigido a GRP78
Las células sanas necesitan una fracción de GRP78 para funcionar normalmente. Sin embargo, células estresadas, como células cancerosas o infectadas por virus, necesita más GRP78 para sobrevivir y multiplicarse, por lo que los tratamientos que reducen la cantidad de GRP78 en el cuerpo podrían reducir la gravedad de la infección por SARS-CoV-2 y propagarse sin efectos adversos.
Si bien este estudio utilizó un anticuerpo monoclonal, Los investigadores dicen que hay otros agentes que podrían usarse para reducir la cantidad o actividad de GRP78, creando múltiples vías para que las posibles soluciones farmacológicas se dirijan al GRP78.
"Lo que es particularmente emocionante de este hallazgo es que GRP78 podría ser un objetivo universal en combinación con las terapias existentes, no solo para combatir COVID-19, pero también otros virus mortales que dependen de GRP78 para su infectividad, "dijo Lee.
El siguiente paso para el equipo de investigación es explorar más estos hallazgos a través de estudios en animales.