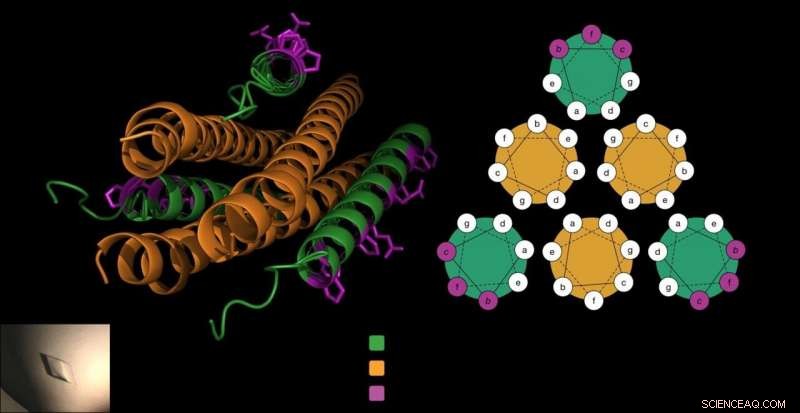
El péptido antivírico está formado por tres sacacorchos (en verde), que se bloquean alrededor de la proteína de fusión del virus (en naranja) para evitar que el virus entre en las células. El laboratorio de Gellman agregó beta aminoácidos únicos al péptido (en púrpura) de una manera que no interfirió con esta interacción crucial y que hizo que el péptido fuera más estable. Crédito:Victor Outlaw.
Al diseñar una pequeña porción de proteína, o péptido, que puede prevenir la unión de los virus de la parainfluenza humana a las células, Los investigadores han mejorado un método en modelos de roedores destinado a ayudar a mantener sanos a los niños.
Virus de la parainfluenza humana, o HPIV, son la principal causa de infecciones respiratorias infantiles, responsable del 30% al 40% de enfermedades como el crup y la neumonía. Los virus también afectan a las personas mayores y a las personas con sistemas inmunológicos comprometidos.
Para enfermar a la gente Los HPIV deben adherirse a las células e inyectar su material genético para comenzar a producir nuevos virus. HPIV3 es el más frecuente entre estos virus. Actualmente no existen vacunas o antivirales aprobados para la infección por HPIV3 en personas.
En un estudio dirigido por el laboratorio Sam Gellman en el departamento de química de la Universidad de Wisconsin-Madison, y el laboratorio de Anne Moscona y Matteo Porotto en la Universidad de Columbia, Los investigadores se basaron en años de trabajo en tratamientos con péptidos para generar uno capaz de bloquear el proceso de unión de HPIV3.
Los investigadores publicaron sus hallazgos el 7 de abril en el Revista de la Sociedad Química Estadounidense .
Para ingresar a las células anfitrionas, Los HPIV utilizan proteínas de fusión especializadas que se asemejan a tres sacacorchos colocados uno al lado del otro. Un trabajo anterior del laboratorio Moscona-Porotto mostró que los científicos podían obtener una parte parcial de esta proteína de sacacorchos de HPIV3, introducir este péptido al virus, y evitar que el sacacorchos impulse el proceso de infección. El péptido sí mismo un sacacorchos, esencialmente se cierra con los sacacorchos del virus, creando un paquete apretado de seis formas de sacacorchos.
El nuevo péptido persiste más tiempo en el cuerpo, por lo que es aproximadamente tres veces más eficaz para bloquear la infección en modelos de enfermedad de roedores que la forma original.
El equipo de investigación comenzó tratando de diseñar el péptido original para que fuera más resistente a las enzimas que digieren proteínas en el cuerpo. que puede triturar proteínas fácilmente y hacerlas inútiles. Entonces, el laboratorio de Gellman recurrió a bloques de construcción inusuales para crear un péptido más resistente.
Las células construyen proteínas a partir de alfa aminoácidos. Pero los químicos pueden crear beta aminoácidos, que son similares pero tienen un átomo de carbono extra. Cuando los péptidos utilizan estos componentes básicos de beta aminoácidos, a menudo toman una forma diferente debido al átomo extra. Esto puede ayudar a un péptido a esconderse de las enzimas que digieren proteínas y sobrevivir más tiempo.
Sin embargo, Los investigadores también sabían que si la forma del péptido cambiaba demasiado como resultado de estos bloques de construcción inusuales, es posible que no se unan con la proteína de fusión en sacacorchos de HPIV.
Ahí es donde las décadas de experiencia del laboratorio Gellman probando y modificando péptidos que contienen beta aminoácidos se volvieron críticas.
"Sabemos qué lado del péptido se une a su proteína objetivo. Entonces, nosotros (sabíamos que) podemos modificar solo los residuos que no están directamente involucrados en la unión de la proteína viral, "dice Victor Outlaw, investigador postdoctoral en el laboratorio y uno de los primeros coautores del informe. En pruebas de laboratorio, vieron que el péptido cuidadosamente modificado todavía se unía fuertemente a la proteína del virus.
En otra mejora iniciada por el laboratorio Moscona-Porotto, los científicos conectaron el péptido a una molécula de colesterol. Esta adición de grasa ayuda a que el péptido se deslice hacia la membrana celular grasosa, dónde puede bloquear mejor el virus.
"Nuestra hipótesis era que la combinación de beta aminoácidos y colesterol aumentaría la eficacia antiviral, "dice Outlaw, quien explicó que el colesterol ayudó a llevar el péptido a donde tenía que ir, mientras que el cambio de forma de los beta aminoácidos permitió que el péptido persistiera más tiempo en el cuerpo.
Como esperaba el equipo de investigación, cuando dieron el nuevo péptido a ratas algodoneras, duró mucho más en los pulmones que la versión anterior gracias a su resistencia a la digestión por enzimas. El péptido se administró a las narices de las ratas.
Para probar qué tan bien funcionó el péptido para prevenir infecciones, las ratas algodoneras recibieron el nuevo péptido antes de ser expuestas a HPIV3. En comparación con los animales que no recibieron péptidos antivirales, los que recibieron el péptido mejorado tenían 10 veces menos virus en sus pulmones.
Y en comparación con el péptido que era más susceptible a las enzimas, el péptido más resistente redujo la carga viral aproximadamente tres veces, lo que sugiere que la capacidad del nuevo péptido para evitar la digestión en el cuerpo lo ayuda a bloquear mejor las infecciones.
Si bien el enfoque aún no se ha probado en humanos y los investigadores deben refinar y probar aún más el sistema, proporciona una nueva estrategia para prevenir o tratar potencialmente estas infecciones comunes.
La colaboración de investigación ahora busca producir péptidos de segunda generación que duren aún más en el cuerpo. También quieren probar qué tan bien el péptido modificado podría bloquear la infección por virus relacionados. Esa investigación adicional podría acercar el tratamiento con péptidos a los ensayos clínicos.
"Fue una reunión muy afortunada de grupos que tenían necesidades y capacidades complementarias, ", dice Gellman." Realmente ha sido un gran esfuerzo conjunto ".