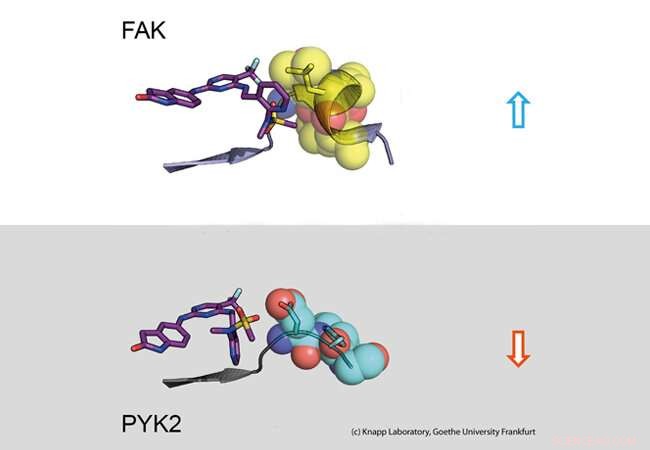
Parte superior:tiempo de residencia prolongado. Un inhibidor (izquierda:modelo de barra) se une a la molécula de señal FAK (derecha:parte de la proteína FAK representada como modelo de calota con esferas). El cambio estructural de FAK provoca contactos hidrofóbicos (amarillo, el llamado motivo DFG) y un compromiso duradero. Parte inferior:tiempo de residencia corto. La proteína señal PYK2 no cambia su estructura al unirse al inhibidor, dando así como resultado una rápida disociación del inhibidor. Crédito:Laboratorio Knapp, Universidad Goethe Frankfurt
Muchos medicamentos contra el cáncer bloquean las señales en las células cancerosas que ayudan a que las células degeneradas se multipliquen sin control y se desprendan de los tejidos. Por ejemplo, bloqueando la proteína de señalización FAK, una llamada quinasa, hace que las células del cáncer de mama se vuelvan menos móviles y, por lo tanto, es menos probable que hagan metástasis. El problema es que cuando FAK es bloqueado por un inhibidor, la proteína de señalización estrechamente relacionada PYK2 se vuelve mucho más activa y, por lo tanto, se hace cargo de algunas de las tareas de FAK. Por tanto, lo ideal sería un inhibidor que inhibiera tanto a FAK como a PYK2 de la misma forma durante el mayor tiempo posible.
Un equipo internacional dirigido por el químico farmacéutico Prof. Stefan Knapp de la Universidad de Goethe ha investigado una serie de inhibidores de FAK especialmente sintetizados. Todos los inhibidores se unieron a la proteína FAK aproximadamente a la misma velocidad. Sin embargo, difirieron en la duración de la unión:el inhibidor más eficaz permaneció unido a la proteína de señalización FAK durante más tiempo.
Utilizando análisis biológicos estructurales y moleculares, así como simulaciones por computadora, el equipo de investigación descubrió que la unión de los inhibidores que permanecen en el bolsillo de unión de FAK durante mucho tiempo induce un cambio estructural. Por lo tanto, a través de la unión de estos inhibidores, FAK cambia su forma y forma un específico, estructura repelente al agua en los sitios de contacto con el inhibidor, comparable a un abrazo íntimo.
La proteína PYK2 estrechamente relacionada, por otra parte, permaneció comparativamente rígido, y aunque el inhibidor de FAK más eficaz también bloqueó PYK2, su efecto fue significativamente más débil debido a la rápida disociación de los inhibidores del sitio de unión. Curiosamente, Las simulaciones por computadora pudieron predecir muy bien la cinética de unión, proporcionando un método para la simulación precisa de las tasas de disociación de fármacos para la optimización futura de candidatos a fármacos.
El profesor Stefan Knapp explica:"Debido a que ahora tenemos una mejor comprensión de los mecanismos moleculares de la interacción de potentes inhibidores de estas dos quinasas, Esperamos poder utilizar simulaciones por ordenador para predecir mejor los tiempos de residencia de los inhibidores y candidatos a fármacos en el futuro. Hasta aquí, Se ha prestado poca atención a las propiedades cinéticas de la unión a fármacos. Sin embargo, esta propiedad ha surgido ahora como un parámetro importante para el desarrollo de fármacos más eficaces que están diseñados para inhibir sus proteínas diana, como en el caso de FAK y PYK2, no solo de forma potente sino también durante mucho tiempo ".