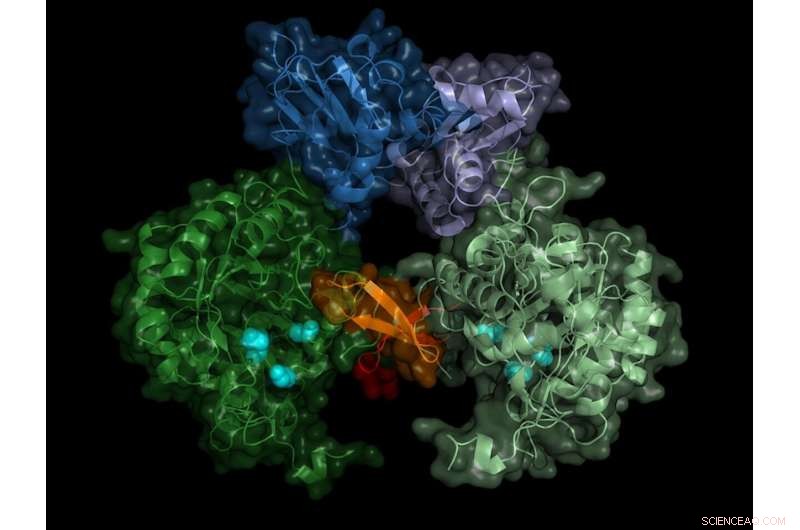
Estructura de la IMP deshidrogenasa del parásito. La enzima activa forma pares (dímeros), la región del "interruptor" (región de Bateman) se muestra en tonos de azul. Crédito:Universidad de Lübeck / DESY, Lars Redecke
Usando flashes de rayos X ultrabrillantes, un equipo de investigadores ha rastreado un objetivo potencial para nuevos medicamentos contra la enfermedad del sueño:los científicos han decodificado la estructura espacial detallada de una enzima vital del patógeno, el parásito Trypanosoma brucei. El resultado proporciona un posible modelo para un medicamento que bloquea específicamente esta enzima y, por lo tanto, mata al parásito. como el equipo dirigido por Christian Betzel de la Universidad de Hamburgo, Lars Redecke de la Universidad de Lübeck y DESY, y Henry Chapman de DESY informa en la revista Comunicaciones de la naturaleza .
La enfermedad del sueño (tripanosomiasis africana) es una enfermedad tropical causada por el parásito Trypanosoma brucei, que se transmite por la picadura de la mosca tsetsé, que habitan gran parte de África tropical. En el cuerpo, el parásito primero se multiplica debajo de la piel, en la sangre y en el sistema linfático y luego migra al sistema nervioso central. Si no se trata, la enfermedad casi siempre es fatal. Gracias a las medidas de control intensivas, el número de casos registrados se ha reducido drásticamente en los últimos años. Sin embargo, La enfermedad del sueño todavía se considera una de las enfermedades tropicales más importantes. Según la Organización Mundial de la Salud, más de 60 millones de personas de las zonas rurales del África subsahariana corren peligro. Guerra, el desplazamiento y la migración pueden hacer que la enfermedad se agrave.
En la búsqueda de un posible punto de partida de fármacos contra el patógeno, los investigadores se habían dirigido a una enzima central del organismo unicelular, inosina-5'-monofosfato deshidrogenasa (IMPDH). "Esta enzima pertenece al inventario central de todos los organismos y es un objetivo interesante para los medicamentos porque regula la concentración de dos nucleótidos vitales en la célula:difosfato de guanosina y trifosfato de guanosina. ", dice Redecke." La célula necesita estos nucleótidos para suministrar energía y construir estructuras más grandes como el genoma. Si interrumpe este ciclo, la celda muere ".
La enzima tiene una especie de interruptor de encendido / apagado que se activa mediante el acoplamiento de las propias moléculas de la célula. Un enfoque prometedor es bloquear este cambio con una molécula diseñada con precisión. Para construir tal inhibidor, Debe conocerse la estructura espacial exacta del conmutador. Los biólogos estructurales pueden determinar la estructura de biomoléculas mediante rayos X. Para hacer esto, primero crecen pequeños cristales de las biomoléculas, que luego generan patrones de difracción característicos cuando se iluminan con rayos X. A partir de estos patrones, la estructura atómica del cristal y sus bloques de construcción, las biomoléculas, se puede calcular.
Este enfoque a menudo se complica por la intratabilidad de la mayoría de las biomoléculas frente a la formación de cristales. Y si se pueden cultivar tales cristales, suelen ser extremadamente sensibles a los rayos X de alta energía y se destruyen rápidamente. "Aunque ya se conocen las estructuras de numerosas IMP deshidrogenasas, no había tenido éxito en el cultivo de cristales de la versión Trypanosoma brucei de la enzima, "informa Betzel, quien también es investigador en el Cluster of Excellence CUI:Advanced Imaging of Matter en la Universidad de Hamburgo y DESY.

La enfermedad es transmitida por la mosca tsetsé. Crédito:CDC, Kay DeWitt (dominio público)
Por lo tanto, el equipo eligió una ruta alternativa:el grupo del coautor Michael Duszenko de la Universidad de Tübingen indujo a ciertas células de insectos a cristalizar biomoléculas dentro de ellas. Usando esta llamada cristalización en celulo, el mismo equipo ya había descifrado otra enzima clave del patógeno de la enfermedad del sueño, catepsina B, que también es un objetivo potencial de drogas. Resultó que las células de insectos alteradas también producen cristales de la deshidrogenasa que ahora se investiga. Estos cristales forman pequeñas agujas de alrededor de 5 milésimas de milímetro (5 micrómetros) de espesor y hasta 70 micrómetros de largo. de modo que sobresalieran de las células productoras.
Los cristales del celulo son tan pequeños que se requieren rayos X muy brillantes para analizarlos. Cuanto más grande es un cristal, Cuantos más átomos en su interior puedan dispersar rayos X, provocando un mejor patrón de difracción. Por lo tanto, los investigadores utilizaron el láser de rayos X LCLS en el Laboratorio Nacional Acelerador SLAC en los EE. UU. Para el análisis. "Los láseres de rayos X generan destellos extremadamente intensos, "explica Chapman, quien es un científico líder en DESY en el Centro de Ciencia de Láser de Electrones Libres CFEL y uno de los portavoces del Cluster of Excellence CUI:Advanced Imaging of Matter. "Aunque los cristales sensibles se evaporan inmediatamente, primero generan un patrón de difracción a partir del cual se puede obtener la estructura ". El método utilizado aquí para explotar estas propiedades, llamada cristalografía en serie de femtosegundos, fue desarrollado anteriormente por muchos de los investigadores involucrados en este estudio y fue nombrado uno de los diez avances más importantes del año por la revista Science en 2013.
El equipo registró los patrones de difracción de más de 22, 000 microcristales y fue capaz de calcular la estructura espacial de la enzima con una precisión de 0,28 millonésimas de milímetro (nanómetro); esto corresponde aproximadamente al diámetro de un átomo de aluminio. "El resultado no solo muestra la estructura exacta del interruptor enzimático, la región de Bateman, pero también qué moléculas de la célula activan el interruptor y cómo estos llamados cofactores se unen al interruptor enzimático, "informa Karol Nass, quien realizó este trabajo durante sus estudios de doctorado en DESY. Ahora trabaja en el Instituto Paul Scherrer en Suiza y es, junto con Redecke, un autor principal de la publicación.
El interruptor es operado por las moléculas de trifosfato de adenosina (ATP) y monofosfato de guanosina (GMP). "La ventaja de nuestro método no es solo que podemos investigar la enzima a temperatura ambiente, en el que la enzima opera naturalmente, pero también que durante la cristalización en celulo los cofactores naturales se unen a la enzima, "dijo Betzel. Según el investigador, los datos ahora podrían proporcionar un enfoque para inhibir la deshidrogenasa IMP del parásito. "Se podría pensar en construir una especie de cierre que cubriera los sitios de unión de ambos cofactores, por ejemplo."
Sin embargo, un desafío pendiente es diseñar el inhibidor de la deshidrogenasa IMP de una manera tan específica que bloquee la enzima del parásito, pero no la enzima humana. Si tiene éxito, el método podría extenderse potencialmente a otros patógenos, explica Betzel. "Otros parásitos tienen una estructura muy similar, y también podría ser posible atacarlos a través de la respectiva IMP deshidrogenasa. La enzima es un objetivo muy interesante para los medicamentos, por ejemplo contra la tenia del zorro o el patógeno de la elefantiasis ".
Las universidades de Hamburgo, Lübeck y Tübingen, la Academia de Ciencias de Rusia, Universidad del estado de Arizona, el Laboratorio Nacional Lawrence Livermore en los EE. UU., el Instituto Max Planck de Investigación Médica, el Laboratorio Nacional Acelerador de EE. UU. SLAC, la Universidad de Gotemburgo y DESY participaron en esta investigación.