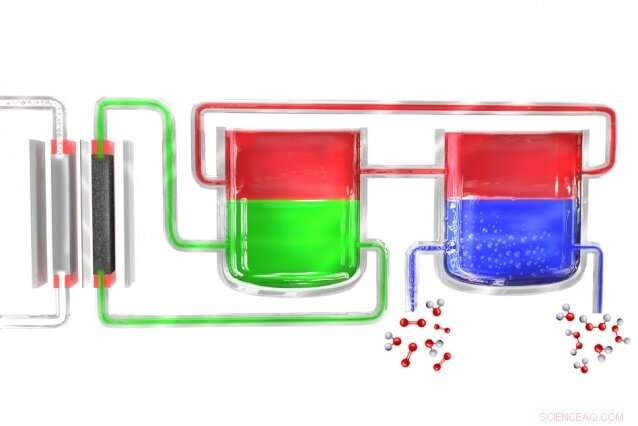
En un nuevo método para producir peróxido de hidrógeno de forma portátil, un electrolizador (izquierda) divide el agua en hidrógeno y oxígeno. Los átomos de hidrógeno se forman inicialmente en un material electrolítico (verde), que los transfiere a un material mediador (rojo), que luego los lleva a una unidad separada donde el mediador entra en contacto con agua rica en oxígeno (azul), donde el hidrógeno se combina con él para formar peróxido de hidrógeno. El mediador luego regresa para comenzar el ciclo nuevamente. Crédito:Instituto de Tecnología de Massachusetts
Peróxido de hidrógeno, un desinfectante multiusos útil, se encuentra en la mayoría de los botiquines del mundo desarrollado. Pero en las aldeas remotas de los países en desarrollo, donde podría desempeñar un papel importante en la salud y el saneamiento, puede ser difícil de conseguir.
Ahora, un proceso desarrollado en el MIT podría conducir a una simple, barato, dispositivo portátil que podría producir peróxido de hidrógeno de forma continua a partir del aire, agua, y electricidad, proporcionando una forma de esterilizar heridas, superficies de preparación de alimentos, e incluso suministros de agua.
El nuevo método se describe esta semana en la revista Joule en un artículo de los estudiantes del MIT Alexander Murray, Sahag Voskian, y Marcel Schreier y los profesores del MIT T. Alan Hatton y Yogesh Surendranath.
Incluso a bajas concentraciones, El peróxido de hidrógeno es un agente antibacteriano eficaz. y después de realizar su función esterilizante se descompone en agua corriente, a diferencia de otros agentes como el cloro que pueden dejar subproductos no deseados de su producción y uso.
El peróxido de hidrógeno es solo agua con un átomo de oxígeno adicional:es H2O2, en lugar de H2O. Ese oxígeno adicional está relativamente débilmente unido, convirtiéndolo en un producto químico altamente reactivo ansioso por oxidar cualquier otra molécula a su alrededor. Es tan reactivo que en altas concentraciones se puede utilizar como combustible para cohetes, e incluso concentraciones del 35 por ciento requieren procedimientos de manipulación y envío muy especiales. El tipo que se usa como desinfectante doméstico es típicamente solo 3 por ciento de peróxido de hidrógeno y 97 por ciento de agua.
Debido a que las concentraciones altas son difíciles de transportar, y bajas concentraciones, siendo mayormente agua, no son económicos de enviar, el material es a menudo difícil de conseguir en lugares donde podría ser especialmente útil, como comunidades remotas con agua no tratada. (Las bacterias en los suministros de agua se pueden controlar de manera efectiva agregando peróxido de hidrógeno). muchos grupos de investigación de todo el mundo han estado buscando enfoques para desarrollar algún tipo de equipo portátil de producción de peróxido de hidrógeno.
La mayor parte del peróxido de hidrógeno producido en el mundo industrializado se produce en grandes plantas químicas, donde el metano, o gas natural, se utiliza para proporcionar una fuente de hidrógeno, que luego se hace reaccionar con oxígeno en un proceso catalítico a alta temperatura. Este proceso consume mucha energía y no es fácilmente escalable. que requieren grandes equipos y un suministro constante de metano, por lo que no se presta a unidades más pequeñas o ubicaciones remotas.
"Hay una comunidad creciente interesada en el peróxido de hidrógeno portátil, "Surendranath dice, "debido a la apreciación de que realmente satisfaría muchas necesidades, tanto en el aspecto industrial como en términos de salud y saneamiento humanos ".
Otros procesos desarrollados hasta ahora para sistemas potencialmente portátiles tienen limitaciones clave. Por ejemplo, la mayoría de los catalizadores que promueven la formación de peróxido de hidrógeno a partir de hidrógeno y oxígeno también producen mucha agua, conduciendo a bajas concentraciones del producto deseado. También, procesos que involucran electrólisis, como lo hace este nuevo proceso, a menudo tienen dificultades para separar el peróxido de hidrógeno producido del material electrolítico utilizado en el proceso, de nuevo conduciendo a una baja eficiencia.
Surendranath y el resto del equipo resolvieron el problema dividiendo el proceso en dos pasos separados. Primero, la electricidad (idealmente de células solares o molinos de viento) se utiliza para descomponer el agua en hidrógeno y oxígeno, y el hidrógeno luego reacciona con una molécula "portadora". This molecule—a compound called anthroquinone, in these initial experiments—is then introduced into a separate reaction chamber where it meets with oxygen taken from the outside air, and a pair of hydrogen atoms binds to an oxygen molecule (O2) to form the hydrogen peroxide. En el proceso, the carrier molecule is restored to its original state and returns to carry out the cycle all over again, so none of this material is consumed.
The process could address numerous challenges, Surendranath dice:by making clean water, first-aid care for wounds, and sterile food preparation surfaces more available in places where they are presently scarce or unavailable.
"Even at fairly low concentrations, you can use it to disinfect water of microbial contaminants and other pathogens, " Surendranath says. And, he adds, "at higher concentrations, it can be used even to do what's called advanced oxidation, " where in combination with UV light it can be used to decontaminate water of even strong industrial wastes, for example from mining operations or hydraulic fracking.
Entonces, por ejemplo, a portable hydrogen peroxide plant might be set up adjacent to a fracking or mining site and used to clean up its effluent, then moved to another location once operations cease at the original site.
In this initial proof-of-concept unit, the concentration of hydrogen peroxide produced is still low, but further engineering of the system should lead to being able to produce more concentrated output, Surendranath says. "One of the ways to do that is to just increase the concentration of the mediator, and fortunately, our mediator has already been used in flow batteries at really high concentrations, so we think there's a route toward being able to increase those concentrations, " él dice.
"It's kind of an amazing process, " él dice, "because you take abundant things, agua, air and electricity, that you can source locally, and you use it to make this important chemical that you can use to actually clean up the environment and for sanitation and water quality."
"The ability to create a hydrogen peroxide solution in water without electrolytes, salt, base, etc., all of which are intrinsic to other electrochemical processes, is noteworthy, " says Shannon Stahl, a professor of chemistry at the University of Wisconsin, que no estuvo involucrado en este trabajo. Stahl adds that "Access to salt-free aqueous solutions of H2O2 has broad implications for practical applications."
Stahl says that "This work represents an innovative application of 'mediated electrolysis.' Mediated electrochemistry provides a means to merge conventional chemical processes with electrochemistry, and this is a particularly compelling demonstration of this concept. … There are many potential applications of this concept."
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre la investigación del MIT, innovación y docencia.