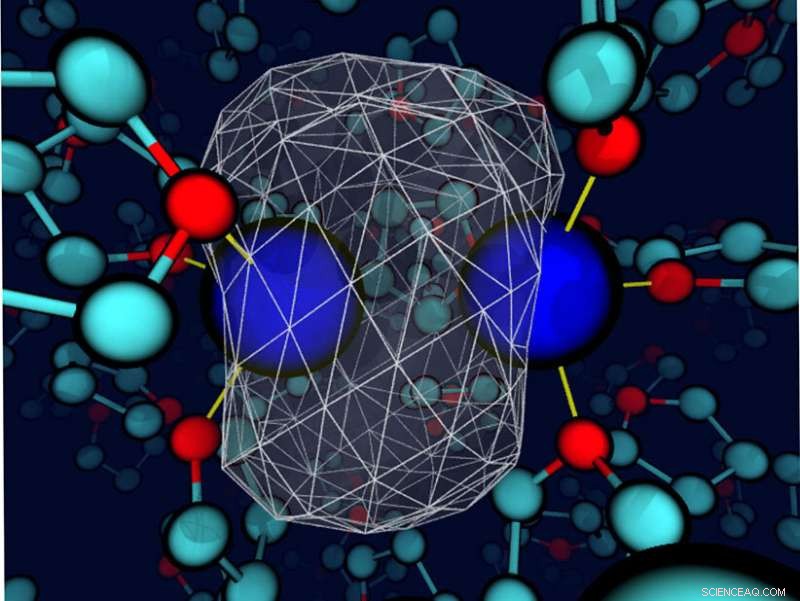
Una "instantánea" revela que el disolvente de tetrahidrofurano circundante deforma la densidad de electrones de enlace alrededor de un soluto de sodio. Los núcleos de sodio son esferas azules; La densidad de los electrones de valencia se representa como una superficie blanca transparente con una malla de alambre blanco que encierra la mayor parte de la densidad de carga. Los enlaces entre el sodio y los sitios de oxígeno de los solventes cercanos son finas líneas amarillas. Crédito:Devon Widmer, Universidad de California, los Angeles
Mezcle algunas almendras enteras en un frasco lleno de avellanas. Sacudir. Las nueces rebotan unas contra otras, pero no reaccionan. Así es como algunas personas piensan sobre las reacciones que ocurren dentro de los líquidos. Los solutos (almendras) reaccionan entre sí en un mar de disolvente (avellanas). Pero un nuevo estudio muestra que este no es siempre el caso de las reacciones químicas reales. En las condiciones adecuadas, el solvente puede cambiar la identidad química del soluto.
Muchas reacciones químicas, particularmente aquellos relevantes para mantener vivas a las personas y las plantas, suceder en solución. Esta investigación muestra que en muchas de estas reacciones, el solvente no es un mero espectador. Eso significa reestructurar las expectativas y los modelos computacionales. Debido a que las mismas reglas podrían aplicarse en los laboratorios de química, los investigadores pueden necesitar seleccionar sus disolventes con más cuidado. Los solventes podrían controlar o cambiar la identidad química del soluto.
Aunque los disolventes se seleccionan cuidadosamente en algunos casos, los líquidos a menudo se consideran simplemente un medio para permitir que los reactivos se encuentren entre sí. Sin embargo, el solvente puede jugar un papel más importante. Aquí, Los investigadores encontraron que cuando el solvente y el soluto interactúan (energéticamente en el mismo orden que un enlace de hidrógeno), el solvente puede controlar la dinámica de enlace y la identidad química de solutos simples. Los investigadores llegaron a esta conclusión al estudiar un dímero de sodio en el tetrahidrofurano, un disolvente débilmente polar. Las interacciones de enlace entre el disolvente y los átomos de sodio condujeron a estados de coordinación únicos. Estos estados tuvieron que cruzar una barrera de energía libre, esencialmente experimentando una reacción química, interconvertir. Más lejos, cada estado de coordinación tenía su propia dinámica y firmas espectroscópicas. Aunque los químicos conocen desde hace mucho tiempo la influencia de los disolventes en ciertos casos, Esta investigación destaca el valor de seleccionar cuidadosamente el solvente para crear un ambiente específico en ciertos sistemas químicos de fase condensada.