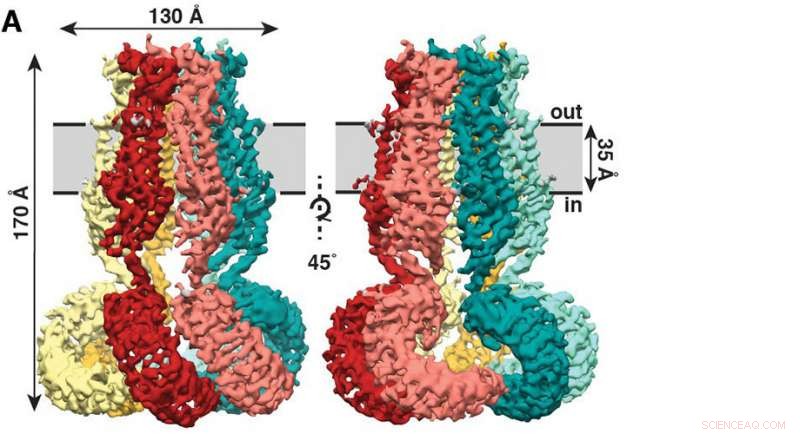
El nuevo estudio, publicado recientemente en la revista eLife , muestra que SWELL1 está formado por seis subunidades que se encuentran en la parte superior, amontonándose para formar un manto parecido a una medusa con seis zarcillos colgando. Crédito:Kefauver et al, Investigación de Scripps
Los científicos de Scripps Research han resuelto la estructura de una proteína clave que detecta cuando nuestras células se hinchan. Esta proteína, llamado SWELL1 (o LRRC8A), funciona como un "canal de iones" en la membrana celular para aliviar la presión dentro de las células.
El nuevo estudio, publicado recientemente en la revista eLife , muestra que SWELL1 está formado por seis subunidades que se encuentran en la parte superior, amontonándose para formar un manto parecido a una medusa con seis zarcillos colgando.
"Esta estructura proporciona un primer vistazo de cómo este canal iónico detecta los cambios de volumen en una célula, "dice Jennifer Kefauver, estudiante de posgrado en Scripps Research, el Instituto Médico Howard Hughes, y primer autor del nuevo estudio.
SWELL1 fue descubierto en 2014 en el laboratorio de Ardem Patapoutian, Doctor., profesor de Scripps Research e investigador del Instituto Médico Howard Hughes. El descubrimiento abrió la puerta a estudios cruciales sobre cómo funciona la proteína.
El siguiente paso importante fue arrojar luz sobre la estructura molecular de SWELL1. Los científicos tenían como objetivo comprender los conceptos básicos de cómo este canal de iones detecta cambios de volumen. Para hacer esto, necesitaban echar un vistazo a la maquinaria molecular del canal.
Kefauver encabezó los estudios como estudiante conjunto entre los laboratorios de Patapoutian y Andrew Ward, Doctor., profesor de Scripps Research y líder en una técnica de obtención de imágenes de alta resolución llamada microscopía crioelectrónica (cryo-EM). Kefauver utilizó técnicas de crio-EM para resolver la estructura similar a una medusa de SWELL1 y obtener un primer vistazo a cómo los iones pueden viajar a través del poro central del canal. "Jennifer persiguió la estructura de SWELL1 con gran tenacidad, sin dejar piedra sin remover y superando innumerables obstáculos. Fue maravilloso ver los frutos de su trabajo dar como resultado una estructura tan hermosa, "dijo Ward.
Esta nueva mirada al canal iónico sugiere que las partes que interactúan de los zarcillos (sitios que tienen una carga positiva o negativa) detectan un cambio en la fuerza iónica en la célula (una dilución del contenido de sal de la célula a medida que absorbe agua). Los residuos cargados podrían enviar una señal hasta el poro del canal, decirle al canal que libere iones de cloruro de la celda y alivie la presión.
Kefauver espera que esta nueva visión de la estructura pueda impulsar la investigación médica. SWELL1 tiene un papel en al menos una enfermedad:una inmunodeficiencia llamada agammaglobulinemia. "Tener la estructura es realmente importante para los científicos que intentan comprender cómo funciona este canal y qué podrían hacer las mutaciones que causan enfermedades".
Próximo, los investigadores observaron más de cerca cómo las diferentes partes de la estructura SWELL1 afectan la función del canal. Descubrieron que la mutación de la proteína en cualquiera de los dos sitios evita que la estructura controle adecuadamente el tráfico a través del canal iónico.
El nuevo estudio muestra paquetes de la subunidad SWELL1 sola, y los científicos saben que SWELL1 tiene que estar ahí para un canal funcional. Pero hasta otras cuatro subunidades pueden intercambiarse en la estructura en diferentes sitios. Kefauver dice que el siguiente paso es determinar cómo las diferentes combinaciones de subunidades SWELL1 se unen para formar canales iónicos con diferentes actividades.