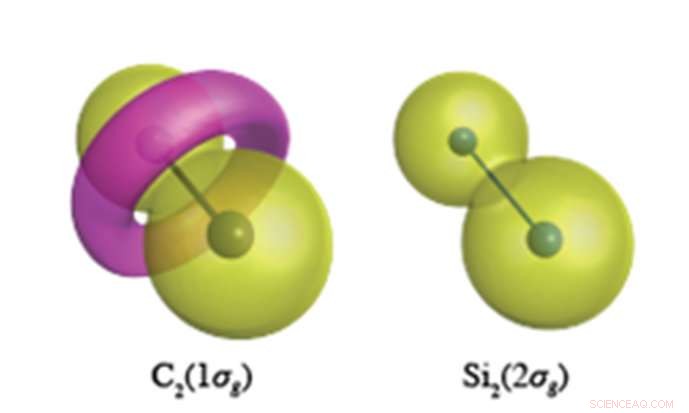
Se espera que los electrones del núcleo interno tengan una función de onda similar a la del maní, como se muestra para Si 2 s electrones (derecha). En el enlace C-C, sin embargo, los electrones C1s forman una característica en forma de toro de polaridad opuesta, se muestra en rosa en la figura de la izquierda. Crédito:Universidad Nacional de Yokohama
Los investigadores de YNU han resuelto el antiguo misterio de por qué el silicio no puede reemplazar al carbono en los compuestos orgánicos. Un nuevo cálculo químico cuántico de referencia de C 2 , Si 2 , y sus hidruros revelan una diferencia cualitativa en las topologías de orbitales de electrones centrales de moléculas orgánicas y sus análogos de silicio. Los investigadores proponen otros elementos con la propensión del carbono a remodelar sus estructuras nodales de electrones centrales mediante enlaces químicos.
Desde el descubrimiento del silicio y el éxito de Wöhler a mediados del siglo XIX con la síntesis de compuestos orgánicos, El propio Wöhler fue uno de los primeros en sugerir la sustitución del carbono por silicio en compuestos orgánicos. Quedó claro a principios del siglo XX que el silicio no tiene una química similar al carbono, y los sueños de vida basada en el silicio solo sobreviven en la ciencia ficción. Sabemos empíricamente que el carbono tiene la capacidad de formar una variedad de compuestos insaturados, que el silicio no lo hace. Sin embargo, la causa fundamental de por qué solo el carbono tiene esta capacidad sigue siendo un misterio.
Los cálculos químicos cuánticos de precisión sin precedentes llevados a cabo en YNU revelan que los electrones del núcleo (que se suponía que no participaban en los enlaces químicos) tienen un papel muy diferente en los compuestos insaturados de carbono y silicio. El carbono tiene la propensión a alterar la topología (estructura nodal) de sus electrones centrales, cuales, para C 2 , da como resultado la formación de un anillo en forma de toro en el orbital 1σg formado por electrones C1s (ver Figura). Si 2 , sin embargo, mantiene los orbitales de núcleo esféricos centrados en cada sitio atómico en todas sus moléculas. Esta flexibilidad de los orbitales del núcleo del carbono permite que el carbono forme una cornucopia de diferentes estructuras de enlaces de valencia, mientras que el silicio está restringido a estructuras de enlace ortogonales a los orbitales atómicos como núcleos esféricos.
El impacto de este descubrimiento es de gran alcance. Hasta ahora se ha supuesto que los electrones del núcleo son más o menos inertes, pero quizás sea necesario reevaluar su contribución al enlace químico, al menos en el caso de enlaces insaturados. Finalmente, el estudio sugiere que otros elementos, como el nitrógeno, fosforoso, y flúor, exhiben una flexibilidad similar para modificar sus topologías electrónicas centrales, y por lo tanto, exhiben químicas igualmente ricas.
El papel, "Topologías electrónicas centrales en compuestos químicos:estudio de caso de carbono frente a silicio, "se publica en Edición internacional Angewandte Chemie vol 57 (24) el 6 de junio, 2018.