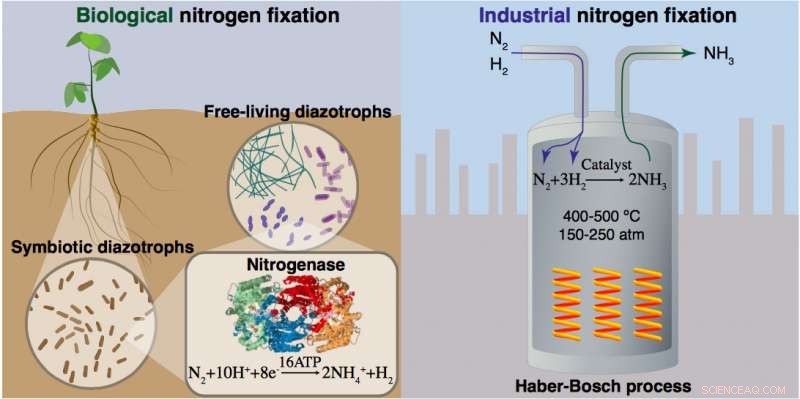
La fijación de nitrógeno ocurre naturalmente en bacterias que contienen la enzima nitrogenasa y puede llevarse a cabo artificialmente a través de un proceso industrial de alta temperatura y alta presión que se basa en catalizadores a base de hierro y grandes cantidades de hidrógeno obtenido del gas natural. Fuente:Informe del taller de la National Science Foundation. Crédito:Laboratorio Nacional Brookhaven
Aproximadamente la mitad del nitrógeno en nuestros cuerpos hoy proviene de bacterias a través de la enzima nitrogenasa, que convierte, o "arreglos, "nitrógeno gas no reactivo en la atmósfera en una forma que las plantas pueden usar para el crecimiento. La otra mitad se produce artificialmente a través de un proceso industrial de uso intensivo de energía desarrollado hace más de 100 años. Este proceso, llamado Haber-Bosch (H-B) en honor a los dos químicos que lo desarrollaron, produce amoníaco mediante el uso de catalizadores a base de hierro para promover la reacción del nitrógeno del aire y el hidrógeno derivado principalmente del metano. A través de otro proceso químico (Ostwald), el amoníaco se oxida (reacciona con el oxígeno) para producir ácido nítrico, un ingrediente fertilizante clave.
Si bien el proceso H-B revolucionó nuestra capacidad para cultivar alimentos, está impulsado en gran medida por el uso de combustibles fósiles, consumiendo alrededor del dos por ciento de la energía global. También contribuye enormemente a las emisiones de gases de efecto invernadero, liberando el dos por ciento del dióxido de carbono global.
Hoja de ruta para la investigación de la química del nitrógeno
Encontrar rutas más respetuosas con el medio ambiente y la energía para transformar el nitrógeno requerirá el desarrollo de nuevos catalizadores para acelerar las reacciones químicas y fuentes de energía renovables para impulsar estas reacciones. En octubre de 2016, La Oficina de Ciencias del Departamento de Energía de EE. UU. (DOE) patrocinó un taller de dos días para científicos universitarios y de laboratorio nacionales con la experiencia relevante para enfocarse en los desafíos y oportunidades de la activación de nitrógeno. Un artículo de revisión, principalmente basado en presentaciones y discusiones de este taller, fue publicado el 25 de mayo en la revista Ciencias .
"El artículo proporciona una hoja de ruta para la investigación fundamental sobre las reacciones de transformación del nitrógeno, "dijo el primer y co-autor correspondiente Jingguang Chen, químico senior en el Laboratorio Nacional Brookhaven del DOE y profesor Thayer Lindsley de Ingeniería Química en la Universidad de Columbia. "Muchas de estas reacciones pueden ocurrir en condiciones relativamente suaves, sin las altas temperaturas o presiones requeridas en H-B, pero el desafío es identificar catalizadores que estén activos, selectivo, y estable ". Chen; coautor para correspondencia Richard Crooks, la Cátedra Robert A. Welch en Química de Materiales en la Universidad de Texas en Austin; y Lance Seefeldt, profesor del Departamento de Química y Bioquímica de la Universidad Estatal de Utah, propuso conjuntamente el tema y copresidió el taller.
La investigación sobre rutas alternativas para la transformación del nitrógeno sin el uso de combustibles fósiles como fuente de energía comienza con un análisis de la termodinámica. Para reducir u oxidar el gas nitrógeno, el triple enlace muy estable que mantiene firmemente unidos a los dos átomos de nitrógeno debe romperse.
"Antes de intentar encontrar nuevos catalizadores con las propiedades adecuadas, Necesitamos determinar si las vías de reacción de las rutas alternativas son energéticamente viables, ", explicó el coautor y químico de Brookhaven Lab Sergei Lymar." Existen muchas rutas termodinámicamente factibles, pero se han pasado por alto en gran medida durante los últimos 100 años porque H-B ha tenido tanto éxito. Si bien no hay garantía de que podamos ejecutar estas reacciones a gran escala, los cálculos termodinámicos nos proporcionan un punto de partida desde el que podemos seleccionar materiales catalíticos potenciales ".
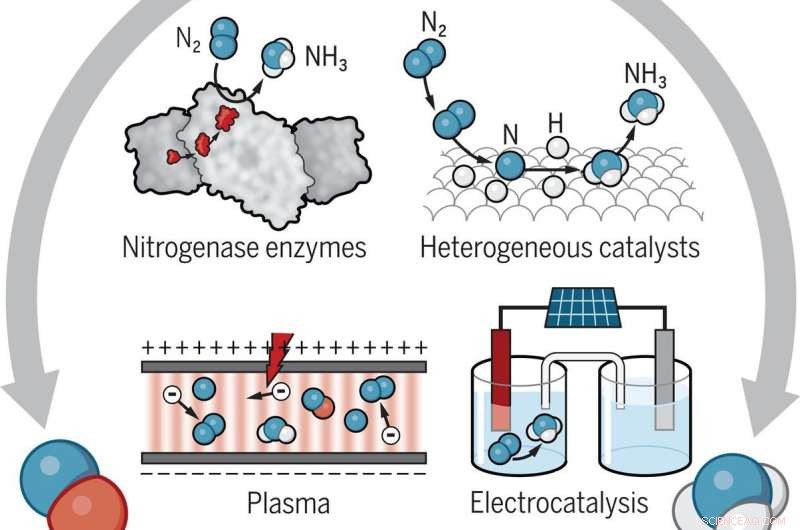
Hay varias rutas posibles para transformar el gas nitrógeno (N2), amoniaco (NH3), y óxidos de nitrógeno (NOy) que eliminan o minimizan la necesidad de combustibles fósiles. Enzimas nitrogenasas, como los que se encuentran en las bacterias; diferentes tipos de catalizadores; y plasmas no térmicos constituidos por iones, electrones, y las moléculas excitadas se encuentran entre las posibilidades que están investigando los científicos. Crédito:Laboratorio Nacional Brookhaven
Posibles rutas para transformar el nitrógeno
El artículo de Science describe varios procesos alternativos para las transformaciones oxidativas y reductoras de nitrógeno. En el lado de la reducción, una posibilidad es reemplazar el metano con agua como fuente de hidrógeno en el proceso H-B. Un catalizador podría dividir el agua en hidrógeno y oxígeno, utilizando energía generada por paneles solares o turbinas eólicas. Otra idea es eliminar el proceso H-B por completo, en lugar de producir directamente amoníaco en celdas electroquímicas con electrocatalizadores o fotocatalizadores (materiales sensibles a la luz) en los electrodos. Las células podrían funcionar con energía renovable o incluso con bacterias fijadoras de nitrógeno.
"Las transformaciones electroquímicas son intrínsecamente limpias, ", dijo Crooks." Pero la cantidad limitada de investigación que se ha dirigido hacia la electroquímica del nitrógeno ni siquiera ha establecido una dirección clara para futuras investigaciones ".
Los científicos también están tratando de comprender cómo funciona la nitrogenasa a bajas temperaturas y presiones y sin gas hidrógeno. Si pueden imitar la función de esta enzima, podrían diseñar nuevos catalizadores moleculares de reducción de nitrógeno que operen en condiciones menos duras que las de H-B.
Estos enfoques sostenibles permitirían producir amoníaco de manera distribuida en lugar de a través de las instalaciones centralizadas de H-B actualmente en funcionamiento. Esta producción distribuida es especialmente importante en los países en desarrollo que se enfrentan a un rápido crecimiento de la población, pero no tienen suficiente capital para construir grandes plantas químicas y la infraestructura para transportar fertilizantes. Si se instalan paneles solares cerca de campos agrícolas, por ejemplo, la energía de la luz solar podría crear los electrones energéticos necesarios para reducir el nitrógeno a amoníaco, si se dispone de catalizadores apropiados.
En el lado de la oxidación, Los científicos están investigando la reacción directa entre el nitrógeno y el oxígeno gaseoso para producir ácido nítrico. Casi la totalidad de los 50 millones de toneladas de ácido nítrico que se producen anualmente se fabrica indirectamente mediante el proceso de Ostwald mediante la oxidación del amoníaco generado por H-B.
"La forma actual en que se produce el ácido nítrico es un poco al revés desde el punto de vista del flujo de electrones, "dijo Lymar." Primero, el nitrógeno se reduce hasta el amoníaco y luego el amoníaco se oxida hasta el ácido nítrico, que abarca los ocho estados de oxidación del nitrógeno. Sería más práctico oxidar directamente el nitrógeno con oxígeno, pero esta reacción se vuelve espontánea sólo a temperaturas extremas ".
Una idea para superar este problema es oxidar el nitrógeno a baja temperatura, Plasmas no térmicos:gases débilmente ionizados que contienen electrones energéticos "calientes" y moléculas cercanas a la temperatura ambiente. átomos, e iones. Al excitar vibratoriamente las moléculas de nitrógeno, Los plasmas no térmicos podrían ayudar a los catalizadores a acelerar la reacción de oxidación.
El artículo también describe enfoques para reducir los óxidos de nitrógeno que contaminan el aire. Estos gases se producen cuando el nitrógeno y el oxígeno reaccionan durante la combustión. El escape de los vehículos es una fuente importante de óxidos de nitrógeno, que contribuyen a la formación de smog y lluvia ácida. Ciertas bacterias tienen enzimas que reducen los óxidos de nitrógeno a gas nitrógeno, y estas bacterias desnitrificantes probablemente serán una fuente de inspiración para los científicos que buscan diseñar nuevos catalizadores para la protección del medio ambiente.
"El progreso en cualquiera de estas áreas requerirá un conocimiento a nivel molecular de las reacciones de transformación de nitrógeno naturales y artificiales, ", dijo Chen." El objetivo de este artículo es proporcionar instrucciones para la investigación básica, es de esperar que conduzca al desarrollo de rutas de baja energía para manipular los estados redox del nitrógeno ".