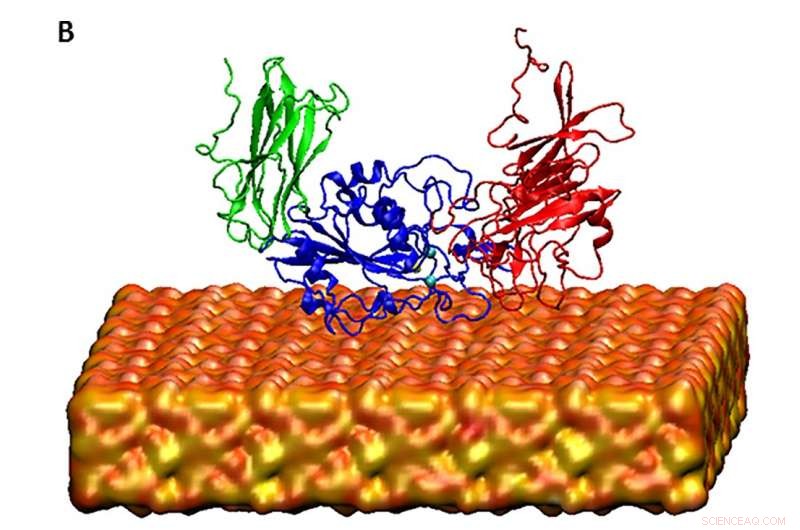
Las supercomputadoras XSEDE Stampede en TACC y Comet en SDSC ayudaron a los autores del estudio a simular el dominio de la pieza principal de la integrina del receptor de proteína de la membrana celular en solución, basado en modelos de dinámica molecular. Crédito:Davoud Ebrahimi
Algunos secretos para reparar nuestros esqueletos se pueden encontrar en las sedosas telarañas de las arañas, según experimentos recientes guiados por supercomputadoras. Los científicos involucrados dicen que sus resultados ayudarán a comprender los detalles de la osteorregeneración, o cómo se regeneran los huesos.
Un estudio encontró que los genes podrían activarse en células madre humanas que inician la biomineralización, un paso clave en la formación de hueso. Los científicos lograron estos resultados con seda artificial derivada de la línea de arrastre de las telas de araña tejedoras de orbes doradas, que combinaron con sílice. El estudio apareció en septiembre de 2017 en la revista Materiales funcionales avanzados y ha sido el resultado del esfuerzo combinado de tres instituciones:Tufts University, Instituto de Tecnología de Massachusetts y Universidad de Nottingham Trent.
Los autores del estudio utilizaron las supercomputadoras Stampede1 en el Texas Advanced Computing Center (TACC) de la Universidad de Texas en Austin y Comet en el San Diego Supercomputer Center (SDSC) de la Universidad de California San Diego a través de una asignación de XSEDE, el eXtreme Science and Engineering Discovery Environment, financiado por la National Science Foundation. Las supercomputadoras ayudaron a los científicos a modelar cómo el receptor de proteína de la membrana celular llamado integrina se pliega y activa las vías intracelulares que conducen a la formación de hueso. La investigación ayudará a realizar mayores esfuerzos para curar enfermedades del crecimiento óseo como la osteoporosis o la enfermedad de la válvula aórtica calcificada.
"Este trabajo demuestra un vínculo directo entre los biomateriales de seda-sílice y las vías intracelulares que conducen a la osteogénesis, "dijo la coautora del estudio Zaira Martín-Moldes, becario postdoctoral en el Kaplan Lab de la Universidad de Tufts. Investiga el desarrollo de nuevos biomateriales basados en la seda. "El material híbrido promovió la diferenciación de las células madre mesenquimales humanas, las células progenitoras de la médula ósea, a los osteoblastos como indicador de osteogénesis, o formación de tejido similar al hueso, "Dijo Martín-Moldes.
"Se ha demostrado que la seda es un andamio adecuado para la regeneración de tejidos, debido a sus excelentes propiedades mecánicas, "Martín-Moldes explicó. Es biodegradable. Es biocompatible. Y se puede ajustar con precisión mediante modificaciones de bioingeniería. El equipo experimental de la Universidad de Tufts modificó la secuencia genética de la seda de las arañas tejedoras orbe doradas (Nephila clavipes) y fusionó el péptido promotor de la sílice R5". derivado de un gen de la diatomea Cylindrotheca fusiformis silaffin.
El estudio de formación ósea se centró en la biomineralización, un proceso crítico en biología de materiales. “Nos encantaría generar un modelo que nos ayude a predecir y modular estas respuestas tanto en términos de prevenir la mineralización como de promoverla, "Dijo Martín-Moldes.
"Se utilizan simulaciones de supercomputación de alto rendimiento junto con enfoques experimentales para desarrollar un modelo para la activación de la integrina, que es el primer paso en el proceso de formación ósea, "dijo el coautor del estudio, Davoud Ebrahimi, un asociado postdoctoral en el Laboratorio de Mecánica Atomística y Molecular del Instituto de Tecnología de Massachusetts.
La integrina se incrusta en la membrana celular y media las señales entre el interior y el exterior de las células. En su estado latente, la unidad principal que sobresale de la membrana está doblada como un durmiente que cabecea. Este estado inactivo evita la adhesión celular. En su estado activado, la unidad principal se endereza y está disponible para la unión química en su región de ligando expuesta.
"El muestreo de diferentes estados de la conformación de las integrinas en contacto con superficies silicificadas o no silicificadas podría predecir la activación de la vía, "Explicó Ebrahimi. El muestreo del plegamiento de proteínas sigue siendo un problema clásico computacionalmente costoso, a pesar de los recientes y grandes esfuerzos en el desarrollo de nuevos algoritmos.
La quimera de seda y sílice derivada que estudiaron pesaba alrededor de 40 kilodaltons. "En esta investigación, lo que hicimos para reducir los costos computacionales, solo hemos modelado la pieza principal de la proteína, que está en contacto con la superficie que estamos modelando, "Dijo Ebrahimi." Pero de nuevo, es un gran sistema para simular y no se puede hacer en un sistema ordinario o en computadoras ordinarias ".
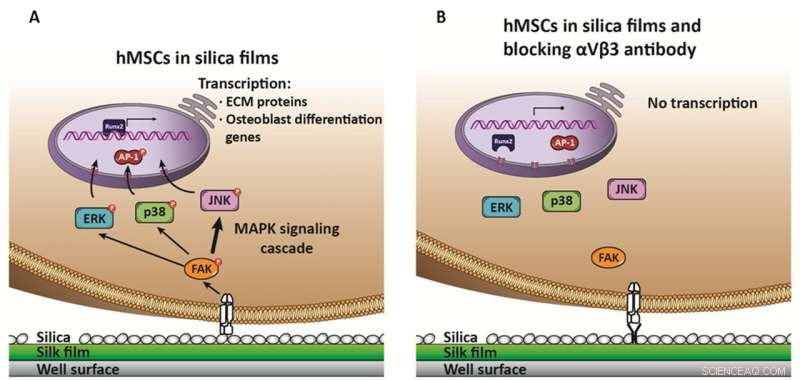
Mecanismo propuesto para la inducción de la osteogénesis de hMSC en superficies de sílice. La unión de la integrina αVβ3 a la superficie de la sílice promueve su activación, que desencadena una cascada de activación que involucra las tres vías MAPK, ERK, p38, pero principalmente JNK (reflejado como una flecha más ancha), que promueve la activación y translocación de AP-1 al núcleo para activar el factor de transcripción Runx2. Runx2 es el responsable final de la inducción de proteínas de la matriz extracelular ósea y otros genes de diferenciación de osteoblastos. B) En presencia de un anticuerpo neutralizante contra αVβ3, no hay activación e inducción de cascadas MAPK, por lo tanto, no hay inducción de genes de la matriz extracelular ósea y, por lo tanto, sin diferenciación. Crédito:Davoud Ebrahimi
El equipo de Computación del MIT utilizó el paquete de dinámica molecular llamado Gromacs, un software para simulación química disponible en los sistemas de supercomputación Stampede1 y Comet. "Podríamos realizar esas grandes simulaciones al tener acceso a clústeres computacionales XSEDE, " él dijo.
"Tengo una experiencia positiva de muchos años con el uso de recursos XSEDE, ", dijo Ebrahimi." Los he estado usando durante casi 10 años para mis proyectos durante mis experiencias de posgrado y posdoctorado. Y el personal de XSEDE es realmente útil si tiene algún problema. Si necesita un software que debería estar instalado y no está disponible, lo ayudan y lo guían a través del proceso de investigación. Recuerdo que intercambié muchos correos electrónicos la primera vez que intenté usar los clústeres, y yo no era tan familiar. Recibí mucha ayuda de los recursos de XSEDE y de la gente de XSEDE. Realmente aprecio el tiempo y el esfuerzo que pusieron para resolver problemas computacionales que generalmente encontramos durante nuestra simulación. "Reflexionó Ebrahimi.
La computación combinada con la experimentación ayudó a avanzar en el trabajo de desarrollo de un modelo de osteorregeneración. "Proponemos un mecanismo en nuestro trabajo, "explicó Martín-Moldes, "que comienza con la superficie de la seda de sílice que activa un receptor de proteína específico de la membrana celular, en este caso, la integrina αVβ3 ". Dijo que esta activación desencadena una cascada en la célula a través de tres vías de proteína quinasa activada por mitógenos (MAPK), la principal es la cascada de cinasa N-terminal c-Jun (JNK).
Agregó que en este proceso también intervienen otros factores como Runx2, el principal factor de transcripción relacionado con la osteogénesis. Según el estudio, el sistema de control no mostró ninguna respuesta, y tampoco lo hizo el bloqueo de la integrina usando un anticuerpo, confirmando su implicación en este proceso. "Otro resultado importante fue la correlación entre la cantidad de sílice depositada en la película y el nivel de inducción de los genes que analizamos, "Estos factores también proporcionan una característica importante a controlar en el futuro diseño de materiales para biomateriales formadores de hueso", dijo Martín-Moldes.
"Estamos haciendo una investigación básica aquí con nuestros sistemas de seda-sílice, ", Explicó Martín-Moldes." Pero estamos ayudando a construir el camino para generar biomateriales que podrían usarse en el futuro. La mineralización es un proceso crítico. El objetivo final es desarrollar estos modelos que ayuden a diseñar los biomateriales para optimizar el proceso de regeneración ósea, cuando se requiere que el hueso se regenere o para minimizarlo cuando necesitamos reducir la formación de hueso ".
Estos resultados ayudan a avanzar en la investigación y son útiles en esfuerzos más amplios para ayudar a curar y tratar enfermedades de los huesos. "Podríamos ayudar a curar enfermedades relacionadas con la formación ósea, como enfermedad de la válvula aórtica calcificada u osteoporosis, que necesitamos conocer la vía para controlar la cantidad de hueso formado, para reducirlo o aumentarlo, Dijo Ebrahimi.