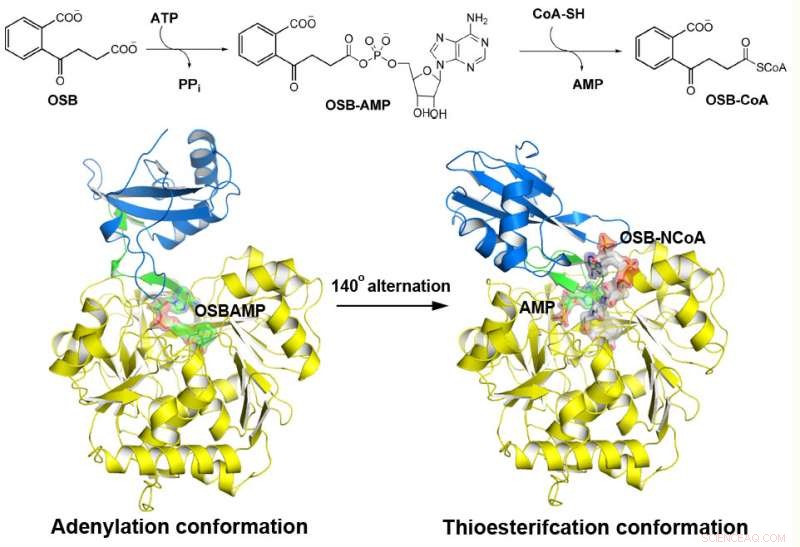
MenE cataliza una reacción de dos pasos en dos estructuras diferentes. Crédito:Departamento de Química, HKUST
La o-succinilbenzoil-CoA (OSB-CoA) sintetasa (MenE) es una enzima esencial en la biosíntesis de vitamina K bacteriana y un objetivo importante en el desarrollo de nuevos antibióticos. Es un miembro de la familia de enzimas adenilantes (ANL), que reconfiguran su sitio activo en dos conformaciones activas diferentes, uno para la semirreacción de adenilación y el otro para una semirreacción de tioesterificación, en un mecanismo catalítico de alternancia de dominios. Aunque recientemente se han descubierto varios aspectos del mecanismo de adenilación en MenE, su conformación de tioesterificación sigue siendo esquiva.
Usando una proteína mutante de Bacillus subtilis catalíticamente competente complejada con un análogo OSB-CoA, Investigadores de la Universidad de Ciencia y Tecnología de Hong Kong revelaron un sitio activo de tioesterificación específicamente conservado entre los ortólogos de MenE y un modo de unión al sustrato distinto de los de muchas otras acil / aril-CoA sintetasas. Se identificaron varios residuos que contribuyen específicamente a la semirreacción de tioesterificación sin afectar la semirreacción de adenilación, y también observaron un movimiento sustancial del grupo succinilo activado en la semirreacción de tioesterificación.
Sus hallazgos fueron publicados en el Revista de química biológica el 21 de julio 2017.
"Nuestros hallazgos proporcionan nuevos conocimientos sobre la catálisis de alternancia de dominios de una enzima bacteriana esencial para la biosíntesis de vitamina K, y de sus homólogos adenilantes en la familia de enzimas ANL, "dijo Zhihong Guo, profesor asociado en el Departamento de Química de HKUST. "Nuestro trabajo validó la hipótesis de que un modo de unión de sustrato distinto es exclusivo de esta enzima".
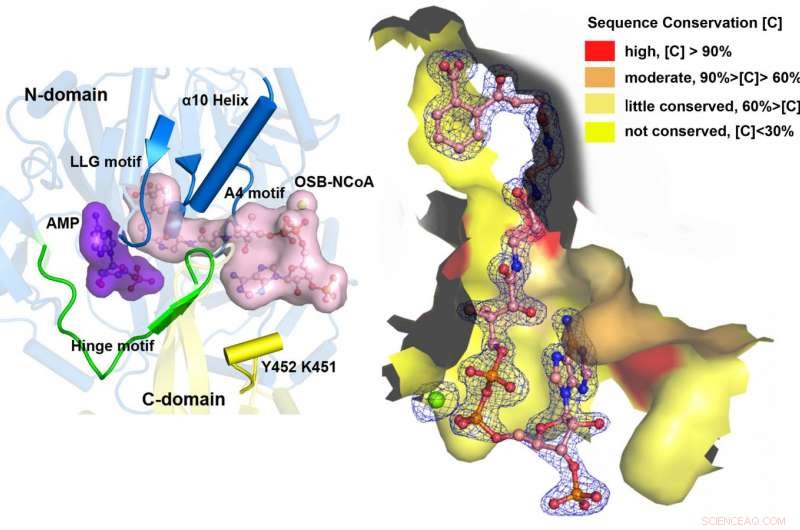
MenE cataliza una reacción de dos pasos en dos estructuras diferentes. Crédito:Departamento de Química, HKUST
Como miembro de la familia de enzimas ANL, OSB-CoA sintetasa (MenE) es un valioso objetivo farmacológico en la vía biosintética de la vitamina K, pero aún se sabe poco sobre la estructura de la enzima.
"Hemos construido estructuras cristalinas de alta resolución de un doble mutante catalíticamente competente (IRAK) de bsMenE en un complejo con un producto análogo estable, OSB-NCoA, y una combinación de OSB-NCoA y AMP, "dijo Guo." Además, estas estructuras cristalinas revelaron los residuos de aminoácidos que contribuyen al reconocimiento y la unión de los sustratos y productos en la reacción de tioesterificación. Estos resultados no solo han proporcionado un apoyo inequívoco para el mecanismo catalítico de alternancia de dominios de las enzimas ANL en general; también han revelado el sitio activo único de tioesterificación de las OSB-CoA sintetasas y han proporcionado la base estructural para su catálisis de la reacción de tioesterificación para facilitar su utilidad como objetivo farmacológico ".
"Nuestros hallazgos proporcionan nuevos conocimientos sobre el mecanismo de alternancia de dominios de la enzima biosintética de vitamina K esencial y sus homólogos en la familia de enzimas ANL, y nos ayudará a construir un ciclo catalítico de proteínas de manera continua, que nadie ha hecho antes ".