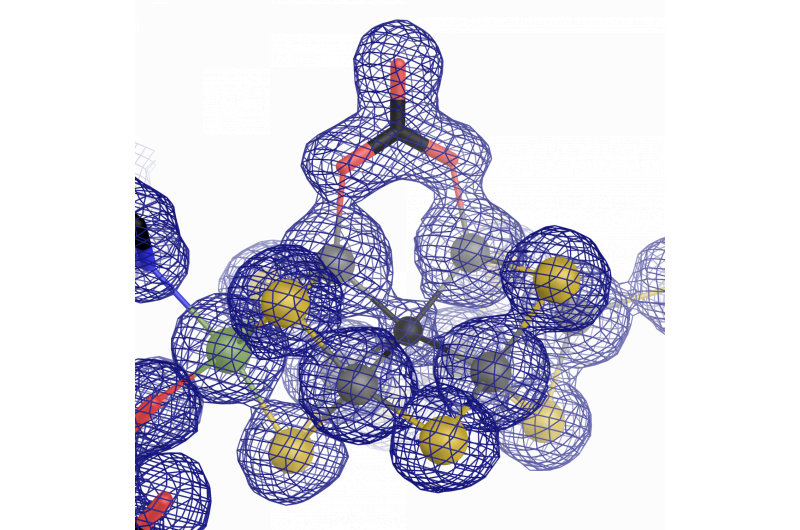
El centro catalítico de la nitrogenasa de vanadio:un cofactor de hierro-vanadio con un ligando de carbonato inusual. Crédito:Oliver Einsle
El equipo de investigación del Prof. Dr. Oliver Einsle del Instituto de Bioquímica de la Universidad de Friburgo ha estado explorando durante mucho tiempo el funcionamiento de la nitrogenasa. Ahora, el grupo está presentando el primer análisis estructural tridimensional de la variante enzimática que contiene vanadio. En el marco de la elaboración de su tesis doctoral, Daniel Sippel logró producir y cristalizar vanadio nitrogenasa. Tomando esto como su base, usó experimentos de difracción de rayos X para dilucidar su estructura espacial a nivel de resolución atómica. El objetivo a largo plazo del equipo es hacer que la nitrogenasa sea biotecnológicamente útil para desarrollar alternativas a los procesos químicos industriales. Los investigadores han presentado sus hallazgos en la revista científica. Biología química de la naturaleza .
El elemento nitrógeno (N) es un componente clave de todas las macromoléculas orgánicas. Su disponibilidad en la biosfera está limitada por el hecho de que la presencia global de nitrógeno se limita en gran medida al gas N2 en la atmósfera. Además, la estabilidad del N2 lo hace inaccesible para casi todos los organismos. El nitrógeno biológicamente disponible para fertilizantes agrícolas se ha elaborado desde 1906 mediante el proceso Haber-Bosch. Este proceso industrial convierte el nitrógeno atmosférico (N2) en amoníaco mediante una reacción con hidrógeno. Su importancia es tan importante hoy en día porque la producción de alimentos para más de la mitad de la población mundial solo puede garantizarse con la ayuda de fertilizantes nitrogenados. En naturaleza, solo una enzima, la nitrogenasa bacteriana, puede lograr la misma reacción, pero sin emitir un exceso de compuestos nitrogenados al medio ambiente, o en otras palabras, lixiviación de nitratos en aguas subterráneas. Sin embargo, hasta ahora la función de este complejo, El sistema enzimático que contiene metal que contiene metal solo se ha explicado parcialmente.
El equipo de Einsle ya ha dado un paso significativo hacia una mayor comprensión de la nitrogenasa. Los investigadores pudieron inhibir la actividad de la enzima utilizando el gas tóxico monóxido de carbono (CO) para mostrar cómo el inhibidor se une al cofactor de hierro y molibdeno (FeMoco). Conocido como el núcleo de la nitrogenasa, ha sido nombrado por los elementos que contiene. FeMoco puede catalizar la reacción de nitrógeno e hidrógeno en una versión natural del proceso Haber-Bosch. Al mismo tiempo, se sabía que una variante de nitrogenasa que contiene vanadio en lugar de molibdeno en su centro activo y, por lo tanto, se llama FeVco también puede convertir monóxido de carbono. Los productos de esta reacción son compuestos de carbono reducido en forma de cadenas de carbono cortas. Esta reacción es la versión enzimática de un segundo proceso químico importante:la síntesis de hidrocarburos de Fischer-Tropsch, que se puede utilizar a gran escala para sintetizar combustibles a partir de gases residuales industriales. por ejemplo.
La nitrogenasa de vanadio que se encuentra en las bacterias del suelo puede, en su entorno natural, realizar la misma síntesis que solo es posible en procesos industriales con la ayuda de presiones extremas y altas temperaturas. Los procesos de Haber-Bosch y Fischer-Tropsch se utilizan anualmente para convertir cientos de millones de toneladas de los gases respectivos - N2 y CO - haciendo la posibilidad de una sostenibilidad, alternativa biológica de considerable interés científico.
Durante el trabajo de investigación, Se hizo evidente que la mayoría de las partes de la arquitectura de la enzima eran similares al molibdeno que contenía el "original". Sin embargo, hay una distinción importante que los distingue:la estructura atómica del cofactor catalítico. Sippel y Einsle encontraron que un ión de vanadio reemplaza al ión de molibdeno en FeVco, e incluye un reemplazo adicional de un ion sulfuro puente con un anión carbonato químicamente muy diferente (μ-1, 3 carbonato - ligando puente). Lo que inicialmente parece ser una pequeña diferencia tiene efectos de gran alcance en la estructura geométrica y electrónica del cofactor.
La investigación está siendo financiada por el Consejo Europeo de Investigación (ERC) y la Fundación Alemana de Investigación (DFG) en el marco del grupo de formación en investigación 1976 "Diversidad funcional de cofactores" de la Universidad de Friburgo y el Programa Prioritario "Hierro-Azufre para Vida."