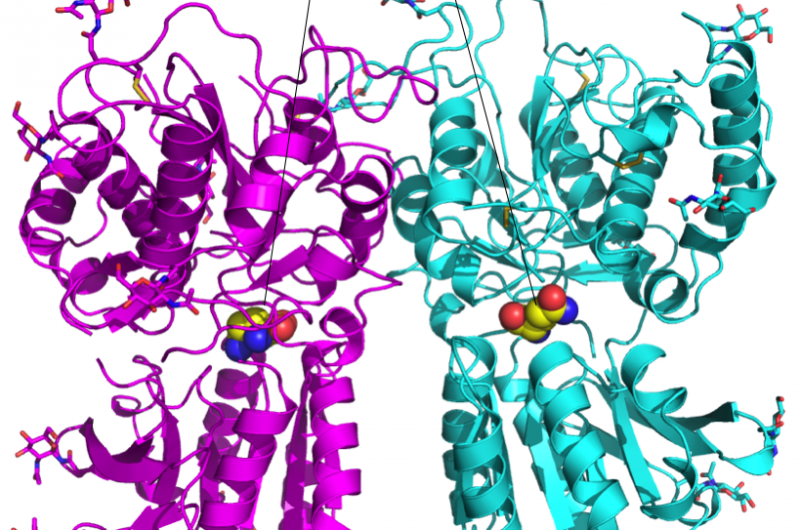
Figura 1:Estructura cristalina del heterodímero del dominio de unión al ligando T1r2-T1r3 del receptor del gusto. Crédito:Universidad de Okayama
Los receptores son la forma en que el cuerpo percibe su entorno. Tras la unión de un ligando, un receptor iniciará una cadena de eventos que provocará una respuesta. Nuestro sistema olfativo depende de aproximadamente 400 receptores para darnos nuestro sentido del olfato. Gusto, sin embargo, opera con un número mucho menor:la combinación de solo tres miembros de la familia del receptor del gusto tipo 1 (T1r) puede detectar una amplia gama de sabores dulces y salados en los seres humanos.
"Los heterodímeros T1r pueden percibir la mayoría de las sustancias de sabor dulce y umami, "dice el profesor Junichi Takagi de la Universidad de Osaka." Para comprender esta percepción, miramos la estructura atómica del heterodímero ".
Nuestros cuerpos sienten un sabor cuando un aminoácido de la comida se une a un heterodímero de dos miembros T1r. Takagi es un experto en biología estructural que estudia las conformaciones físicas de los receptores al unirse a sus ligandos.
"La teoría del candado y la llave explica la mayoría de las uniones ligando-receptor. T1r es inusual porque esta teoría no parece aplicarse. Pensamos que sería un estudio de investigación interesante".
Takagi fue abordado por el profesor Atsuko Yamashita de la Universidad de Okayama, quien había estado estudiando el heterodímero T1r2-T1r3 del pez medaka durante años. Este heterodímero se une a una amplia gama de aminoácidos para la percepción de sabores salados. Para medir la estructura a nivel atómico, utilizaron la experiencia de Takagi, así como el equipo de radiación de sincrotrón en RIKEN SPring-8 en Japón.
El equipo de investigación descubrió que la estructura del heterodímero era aproximadamente la misma independientemente del aminoácido unido, pero la afinidad por el aminoácido se aseguró junto con las moléculas de agua con estructura de caparazón alrededor del aminoácido. Esta característica podría explicar cómo un solo heterodímero puede unirse a una serie de ligandos.
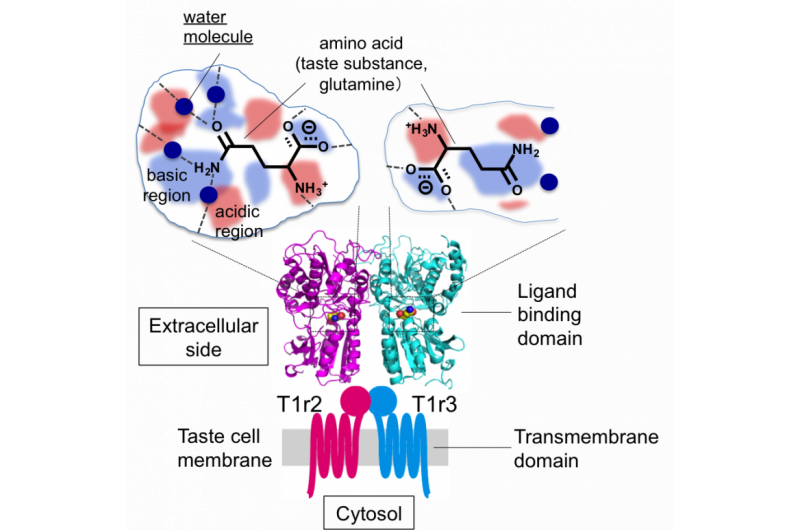
Figura 2:Estructura general del receptor del gusto y dibujo esquemático de las bolsas de unión de sabor-sustancia. Crédito:Universidad de Okayama
"Descubrimos que el espacio en el que el ligando se une a T1r2 es mucho más grande que el ligando en sí. Este espacio más grande podría explicar el agua estructurada, "Dijo Yamashita." El espacio en los receptores de cerradura y llave es mucho más pequeño ".
Una propiedad similar se encuentra en los receptores que pasan diferentes tipos de fármacos, sugiriendo que este mecanismo puede ser constante para receptores no específicos.
Aunque la formación del heterodímero es necesaria para la percepción, los hallazgos indicaron que T1r2 era responsable de detectar diferentes aminoácidos y que la unión a T1r3 no tenía un papel directo en el reconocimiento de sabores.
Por razones de preparación de los receptores, el grupo decidió estudiar el heterodímero T1r2-T1r3 del pez medaka sobre la versión humana. Todavía, porque la familia T1r es universal en animales de niveles superiores, estos hallazgos deberían constituir un modelo informativo para la sensación del gusto en humanos.