
Los investigadores produjeron imágenes en color en placas de cultivo utilizando rojo, verde, y luces azules para controlar el pigmento producido por bacterias con "visión multicolor". Se corrigió el color de la imagen en Photoshop para mejorar el contraste. Crédito:Felix Moser
Los investigadores del MIT han diseñado bacterias con "visión multicolor" —E. coli que reconocen el rojo, verde, o luz azul (RGB) y, en respuesta a cada color, expresan diferentes genes que realizan diferentes funciones biológicas.
Para mostrar la tecnología, los investigadores produjeron varias imágenes en color en placas de cultivo, una de las cuales dice "MIT", mediante el uso de luces RGB para controlar el pigmento producido por las bacterias. Fuera del laboratorio la tecnología también podría resultar útil para fines comerciales, farmacéutico, y otras aplicaciones.
La E. coli está programada con un sistema basado en proteínas y enzimas, análogo a un chip de computadora, con varios módulos diferentes para procesar la entrada de luz y producir una salida biológica. En términos de computación, una "matriz de sensores" se activa primero en presencia de rojo, verde, o luz azul, y un "circuito" procesa la señal. Luego, un "asignador de recursos" conecta la información procesada a "actuadores" que implementan la función biológica correspondiente.
Piense en la nueva E. coli como marionetas microbianas, con luz de colores en lugar de cuerdas de marionetas que hacen que las bacterias actúen de cierta manera, dice el profesor de ingeniería biológica del MIT Chris Voigt, coautor de un artículo en Nature que describe la tecnología. "Usando diferentes colores, podemos controlar diferentes genes que se expresan, " él dice.
Los coautores del artículo son ex postdoctorados Jesús Fernández-Rodríguez, Felix Moser, y Miryoung Song.
La innovación en biología sintética se une
En 2005, Voigt, quien codirige el Centro de Biología Sintética del MIT, y otros investigadores fueron pioneros en una "cámara bacteriana" al programar un sensor de luz en una cepa de E. coli, junto con un gen que produce pigmento negro. Cuando la luz brillaba a través de una plantilla sobre una placa cubierta de bacterias, los microbios formaron imágenes en blanco y negro. En el momento, esta hazaña requirió sólo cuatro genes y tres promotores (regiones de ADN que inician la transcripción de genes) para realizar el trabajo.
Nuevas herramientas de biología sintética, como el sistema de edición del genoma CRISPR, han surgido desde entonces, abriendo posibilidades más amplias a los investigadores. A diferencia del sistema de 2005, el nuevo sistema RGB, el primero en utilizar tres colores, consta de 18 genes y 14 promotores, entre otras partes, así como 46, 000 pares de bases de ADN.
Pero con una mayor complejidad vienen mayores desafíos. Debido a que los investigadores estaban lidiando con una matriz de sensores que podía detectar tres colores separados, por ejemplo, tenían que incluir en el programa microbiano una proteína que previene la transcripción genética de los dos sensores no utilizados.
En términos de computación, esto se llama una "puerta NO, "un circuito que produce una señal de salida, en este caso, represión genética, solo cuando no hay una señal en su entrada. Con bacterias bajo una luz roja por ejemplo, la puerta NOT desataría esa proteína represora de genes en los sensores verde y azul, apagarlos.
Hace unos cinco años, Voigt dirigió un equipo que diseñó microbios para responder a la luz roja y verde. Agregar un tercer sensor fue un gran desafío de la nueva investigación. "Dentro de la celda, todos los nuevos sensores de proteínas que agregas interfieren entre sí, porque son todas las moléculas que chocan alrededor de la célula, y todos requieren mantener la celda viva y feliz. Con cada sensor adicional que agregue, que se vuelve exponencialmente más difícil, " él dice.
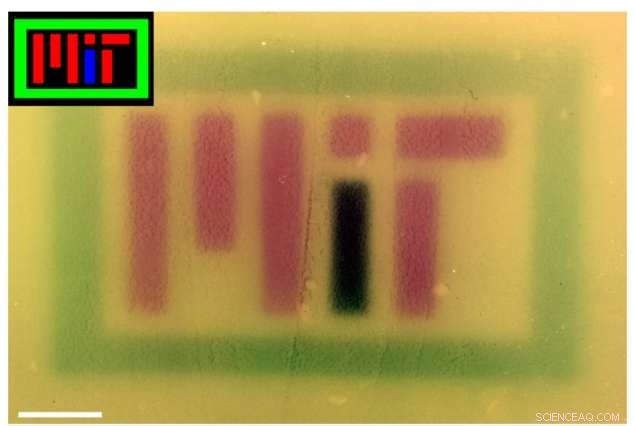
Se proyectaron imágenes coloreadas (recuadros) en placas de bacterias que contenían el sistema RGB para deletrear "MIT". Se corrigió el color de la imagen en Photoshop para mejorar el contraste. Crédito:Felix Moser
En ese sentido, Voigt agrega, el asignador de recursos del sistema, una nueva característica, también actúa como disyuntor, apagar los sensores si los tres se encienden a la vez, sobrecargar la celda.
Desde una perspectiva de ingeniería genética, la configuración de cuatro subsistemas fue "el mayor impacto de este trabajo, "Dice Voigt. Cada subsistema, la matriz de sensores, circuitos, actuadores de recursos, y actuadores — fue diseñado, construido, y optimizado de forma aislada antes de ser ensamblado en una estructura final. Esto simplificado, El proceso modular podría allanar el camino para una programación biológica más compleja en el futuro, según los investigadores.
Generalmente hablando, Voigt ve el nuevo sistema como la culminación de una década de innovaciones en biología sintética. "Es una representación de dónde nos encontramos actualmente, y todas las piezas que tuvieron que unirse durante la última década para crear sistemas de esta escala y complejidad, " él dice.
Haciendo "bacterias disco"
Para hacer las nuevas imágenes en color, los investigadores programaron bacterias para producir el mismo pigmento que el rojo, verde, o una luz azul brillaba sobre ellos. En una incubadora los investigadores cubrieron una placa de Petri con bacterias que son genéticamente idénticas. "Puedes pensar en ello como una película sin revelar, donde tienes la placa de Petri con bacterias, "Voigt dice, "y la cámara es la incubadora".
En la parte superior de la incubadora hay un agujero, donde se proyecta una imagen estarcida en la placa. Tiempo extraordinario, las bacterias crecen, produciendo una enzima que produce un pigmento correspondiente al color RBG que los ilumina. Además del logo del MIT, los investigadores produjeron imágenes de varios patrones, fruta multicolor, y el personaje del videojuego Super Mario.
Las bacterias diseñadas también podrían usarse para iniciar y detener rápidamente las reacciones químicas de los microbios en los procesos de fermentación industrial. que se utilizan para fabricar productos farmacéuticos y otros productos. Hoy dia, controlar tales reacciones químicas requiere verter diferentes aditivos químicos en grandes cubas de fermentación, que consume mucho tiempo y es ineficaz.
En su papel los investigadores demostraron este concepto de "productos químicos a pedido" a pequeña escala. Usando herramientas de edición de genes CRISPR, modificaron tres genes que producen acetato, un subproducto a veces no deseado de varios bioprocesos, para producir menos de la sustancia química en respuesta a las luces RGB.
"Individualmente, y en combinación unos con otros, los diferentes colores de luz reducen la producción de acetato sin sacrificar la acumulación de biomasa, "escribieron los investigadores en su artículo.
Voigt ha acuñado un nombre divertido para estos microbios industriales. "Me refiero a ellos como 'bacterias disco, '" él dice, "porque luces de diferentes colores parpadean dentro del fermentador y controlan las células".
Una aplicación futura, Voigt agrega, podría estar en el control de células para formar diversos materiales y estructuras. Investigadores incluidos algunos en el MIT, han comenzado a programar células para ensamblar en materiales vivos que algún día podrían usarse para diseñar células solares, materiales autocurativos, o sensores de diagnóstico.
"Es increíble cuando miras el mundo y ves todos los diferentes materiales, "Dice Voigt." Cosas como celulosa, proteínas de seda, rieles, nanocables, y materiales vivos como los órganos:todas estas cosas diferentes en la naturaleza las obtenemos de las células que crecen en diferentes patrones. Puedes imaginar el uso de diferentes colores de luz para decirle a las células cómo deberían crecer como parte de la construcción de ese material ".
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre la investigación del MIT, innovación y docencia.