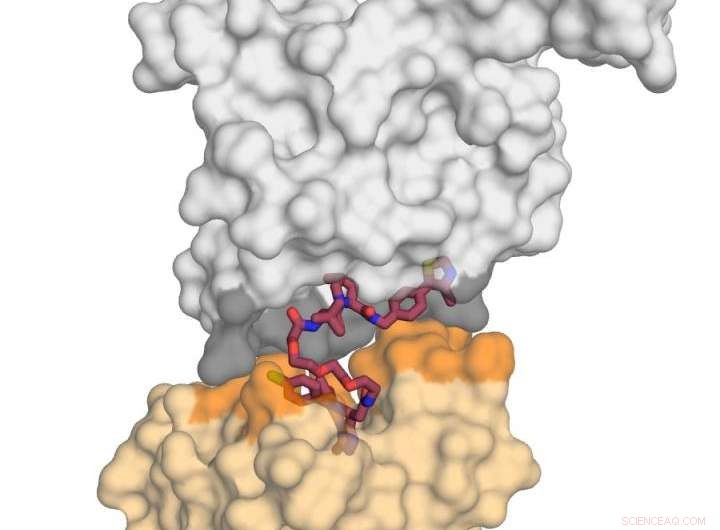
La imagen muestra la proteína ligasa E3 VHL (en gris) en complejo con la molécula pequeña MZ1 (en frambuesa) y 'besando' la proteína BRD4 (en amarillo). Al recibir este 'beso' mortal, BRD4 está destinado a la degradación. Crédito:Xavier Lucas, Alessio Ciulli, Universidad de Dundee
Los científicos de la Universidad de Dundee han informado de un gran avance al abordar las causas de muchas enfermedades, utilizando un "beso de la muerte" para destruir proteínas que anteriormente se consideraban "indiscutibles".
Se sabe mucho sobre proteínas como Ras y Myc, que se sabe que son culpables del cáncer humano, y Huntingtin, que causa la enfermedad de Huntingdon, pero hasta ahora se han mostrado obstinadamente resistentes a los esfuerzos por encontrar formas de combatirlos con drogas.
Ahora, los investigadores dirigidos por el profesor Alessio Ciulli en la Escuela de Ciencias de la Vida en Dundee han encontrado una forma de apuntar a proteínas similares, utilizando un enfoque de molécula pequeña de una manera no convencional para apuntar a proteínas `` malas '' uniéndolas a agentes neutralizantes para iniciar un proceso de degradación, y por lo tanto eliminándolos por completo.
"Conocemos muchas proteínas que son activas en causar enfermedades, pero que no hemos podido evitar que se vuelvan 'pícaros' o detenerlos cuando lo hagan, "dijo el profesor Ciulli.
"El principal problema es que no hemos podido encontrar las moléculas pequeñas que pueden unirse con éxito a estas proteínas y al mismo tiempo obstaculizar su función. Es un área muy compleja:estas proteínas a menudo pueden engañar a los reguladores dentro de la célula y ser extremadamente difícil de precisar con inhibidores.
"La investigación en nuestro laboratorio en los últimos años ha contribuido a establecer un enfoque diferente, uno que se ha teorizado durante muchos años, pero que solo ahora se realiza plenamente con este último trabajo. En lugar de usar la molécula pequeña para intentar desactivar la proteína mala, Hemos desarrollado una forma de modificarlo para que pueda usarse para atraer las proteínas neutralizantes, que luego se unen a su mal vecino y actúan contra él, iniciando un proceso de degradación en cascada.
"Fundamentalmente, También hemos descubierto que no es suficiente que esta proteína neutralizante se asiente cerca de la proteína mala, tiene que hacer contacto directo con él, para "besarlo". Y no solo un besito pero un verdadero abrazo de "Lo que el viento se llevó". A esto lo llamamos un 'beso de la muerte', ya que es la clave para asegurar la degradación de la proteína mala ".
El profesor Ciulli y sus colegas centraron su atención en una molécula de degradación química bivalente llamada 'PROTAC' (moléculas quiméricas dirigidas a la proteólisis). Han podido crear la primera estructura cristalina de rayos X de un PROTAC unido tanto a la proteína 'mala' como al agente 'neutralizante' (una ubiquitina ligasa E3), y descubrió que se puede implementar con éxito como un "imán" para unir las dos proteínas objetivo.
"Este descubrimiento proporciona la primera información sobre cómo funcionan los PROTAC y cómo podemos apuntar a las proteínas para su degradación de una manera altamente selectiva, "dijo el profesor Ciulli.
"Esto presenta un cambio de paradigma en cómo podemos asegurar la intervención química selectiva contra proteínas que sabemos que son factores que causan enfermedades, pero que hasta ahora han sido imposibles de atacar con éxito. Apunta hacia la posibilidad de drogar a los 'no drogables'".
Los resultados de la investigación se publican en la revista Biología química de la naturaleza .
El trabajo realizado por el equipo de Dundee se centró en el emparejamiento de una de las proteínas de bromodominio BET, BRD4, que es un objetivo farmacológico atractivo para el cáncer, con un "degradador" selectivo BRD4 llamado MZ1. Descubrieron que MZ1 podía unir las dos proteínas plegándose sobre sí misma. Una vez que las dos proteínas se unen en su "beso", las interacciones entre ellas conducen a la degradación del objetivo. Mostraron cómo proteínas similares BRD2 y BRD3 no besan también a la proteína neutralizante, y guiados por esta información pudieron diseñar nuevos degradadores que evitan por completo a esas proteínas del proceso de degradación. Esto es importante porque aclara cómo se podrían diseñar moléculas degradantes en el futuro para minimizar los efectos fuera del objetivo de formas que pueden no ser posibles usando inhibidores convencionales.
El equipo de Dundee que trabajaba en el proyecto incluía investigadores postdoctorales en el laboratorio del profesor Ciulli, Morgan Gadd, Andrea Testa, Xavier Lucas y Kwok-Ho Chan, y Wengzhan Chan y Dougie Lamont de Dundee Fingerprints Proteomics Facility.
El profesor Ciulli dijo que ya había señales prometedoras de la industria farmacéutica de una inversión significativa en esta área de investigación.
"Ahora entendemos mejor cómo convertir los inhibidores en degradadores. El camino para convertir los degradadores en drogas será largo y tortuoso y no podremos llegar allí solos. Es emocionante ver señales de un compromiso serio por parte de la industria farmacéutica, lo que se suma al optimismo de que seremos capaces de llegar a un punto en el que podamos drogar a los 'indisciplinados' ".