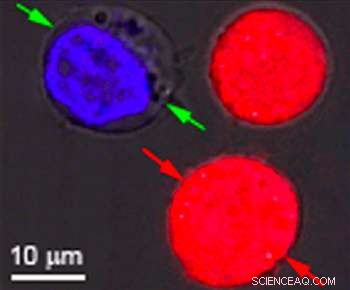
Células idénticas teñidas de rojo y azul fueron el objetivo de una investigación en la Universidad de Rice para mostrar el efecto de las nanoburbujas plasmónicas. Las burbujas se forman alrededor de nanopartículas de oro calentadas que se dirigen a células particulares, como las células cancerosas. Cuando las partículas son huecas, se forman burbujas que son lo suficientemente grandes como para matar la célula cuando estallan. Cuando las partículas son sólidas, las burbujas son más pequeñas y pueden perforar un agujero temporal en la pared de una celda, permitiendo que fluyan drogas u otro material. Ambos efectos se pueden lograr simultáneamente con un solo pulso de láser. Crédito:Laboratorio de nanoburbujas plasmónicas / Universidad de Rice
(Phys.org) —Los investigadores de la Universidad de Rice han encontrado una manera de matar algunas células enfermas y tratar otras en la misma muestra al mismo tiempo. El proceso activado por un pulso de luz láser deja intactas las células sanas vecinas.
El uso exclusivo de nanoburbujas plasmónicas sintonizables desarrollado en el laboratorio Rice de Dmitri Lapotko parece prometedor para reemplazar varios procesos difíciles que ahora se utilizan para tratar pacientes con cáncer. entre otros, con un ayuno sencillo, procedimiento multifuncional.
La investigación es el foco de un artículo publicado en línea esta semana por la revista American Chemical Society. ACS Nano y fue realizado en Rice por Lapotko, la científica investigadora y autora principal Ekaterina Lukianova-Hleb y el estudiante de pregrado Martin Matonga, con la ayuda del Centro de Terapia Celular y Genética de Baylor College of Medicine (BCM), Texas Children's Hospital y el MD Anderson Cancer Center de la Universidad de Texas.
Nanoburbujas plasmónicas que son 10, 000 veces más pequeño que un cabello humano provocan diminutas explosiones. Las burbujas se forman alrededor de nanopartículas de oro plasmónicas que se calientan cuando son excitadas por una fuente de energía externa, en este caso, un pulso de láser corto y vaporizar una fina capa de líquido cerca de la superficie de la partícula. La burbuja de vapor se expande y colapsa rápidamente. Lapotko y sus colegas ya habían descubierto que las nanoburbujas plasmónicas matan las células cancerosas al explotarlas literalmente sin dañar a los vecinos sanos. un proceso que mostró una precisión y selectividad mucho mayor en comparación con los mediados por nanopartículas de oro solo, él dijo.
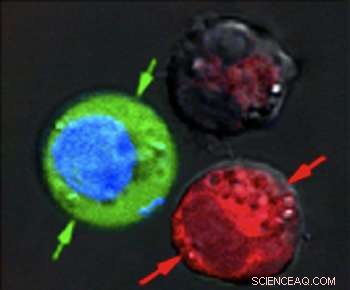
Después del pulso láser, Las células teñidas de rojo muestran evidencia de daño masivo por la explosión de nanoburbujas. mientras que las células teñidas de azul permanecieron intactas, pero con tinte verde fluorescente extraído del exterior. Crédito:Laboratorio de nanoburbujas plasmónicas / Universidad de Rice
El nuevo proyecto lleva esa notable habilidad unos pasos más allá. Una serie de experimentos demostró que un solo pulso de láser crea grandes nanoburbujas plasmónicas alrededor de nanoconchas de oro huecas. y estas grandes nanoburbujas destruyen selectivamente las células no deseadas. El mismo pulso de láser crea nanoburbujas más pequeñas alrededor de nanoesferas de oro sólido que perforan una pequeña, un poro temporal en la pared de una célula y crea un nanojet entrante que rápidamente "inyecta" fármacos o genes en las otras células.
En sus experimentos, Lapotko y su equipo colocaron nanocapas huecas de 60 nanómetros de ancho en células cancerosas modelo y las tiñeron de rojo. En un lote separado, pusieron nanoesferas de 60 nanómetros de ancho en el mismo tipo de células y las tiñeron de azul.
Después de suspender las células juntas en un tinte fluorescente verde, dispararon un solo pulso de láser ancho a la muestra combinada, Lavó la mancha verde y examinó las células bajo un microscopio. Los glóbulos rojos con las nanocapas huecas fueron destrozados por grandes nanoburbujas plasmónicas. Las celdas azules estaban intactas, pero el líquido teñido de verde del exterior había entrado en las células donde nanoburbujas plasmónicas más pequeñas alrededor de las nanopartículas de oro sólido abrieron temporalmente las paredes.
Debido a que todo esto sucede en una fracción de segundo, hasta 10 mil millones de células por minuto podrían procesarse selectivamente en un sistema de flujo continuo como el que se está desarrollando en Rice, dijo Lapotko, becario de la facultad en bioquímica y biología celular y en física y astronomía. Eso tiene potencial para promover la terapia celular y genética y el trasplante de médula ósea, él dijo.
La mayoría de las terapias con células y genes que combaten enfermedades requieren un procesamiento "ex vivo", fuera del cuerpo, de injertos de células humanas para eliminar las células no deseadas (como las cancerosas) y modificar genéticamente otras células para aumentar su eficacia terapéutica. Lapotko dijo. "El procesamiento de la celda actual suele ser lento, caro y laborioso y sufre de altas pérdidas de células y pobre selectividad. Idealmente, tanto la eliminación como la transfección (la introducción de materiales en las células) deberían ser altamente eficientes, selectivo, rápido y seguro ".
La tecnología de nanoburbujas plasmónicas promete "un método para hacer varias cosas en una población celular al mismo tiempo, "dijo Malcolm Brenner, profesor de medicina y pediatría en BCM y director del Centro de Terapia Celular y Genética de BCM, que colabora con el equipo de Rice. "Por ejemplo, si quiero poner algo en una célula madre para convertirla en otro tipo de célula, y al mismo tiempo matan las células circundantes que tienen el potencial de causar daño cuando regresan a un paciente, oa otro paciente, estas nanoburbujas plasmónicas muy sintonizables tienen el potencial de hacer eso ".
El objetivo a largo plazo de un esfuerzo de colaboración entre Rice, BCM, El Texas Children's Hospital y el MD Anderson tienen como objetivo mejorar los resultados de los pacientes con enfermedades cuyo tratamiento requiere procesamiento celular ex vivo. Lapotko dijo.
Lapotko planea construir un prototipo de la tecnología con miras a realizar pruebas con células humanas en un futuro próximo. "Nos gustaría que esta fuera una plataforma universal para la terapia celular y genética y para el trasplante de células madre, " él dijo.