La valencia es una medida de la reactividad de un átomo o molécula. Puede derivar la valencia de muchos elementos mirando sus posiciones en la tabla periódica, pero esto no es cierto para todos ellos. También es posible calcular la valencia de un átomo o molécula observando cómo se combina con otros átomos o moléculas con valencias conocidas.
La regla del octeto
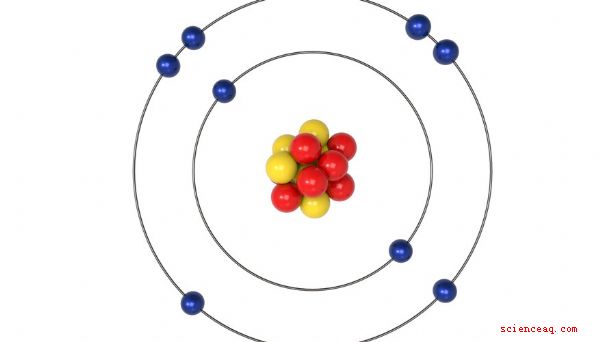
Al determinar la valencia de un átomo o molécula (uno para que no puede usar la tabla periódica para determinar la valencia), los químicos usan la regla del octeto. De acuerdo con esta regla, los átomos y los productos químicos se combinan de tal manera que producen ocho electrones en la capa externa de cualquier compuesto que formen. Una capa externa con ocho electrones está llena, lo que significa que el compuesto es estable.
Cuando un átomo o molécula tiene de uno a cuatro electrones en su capa externa, tiene una valencia positiva, lo que significa que dona sus electrones libres. . Cuando el número de electrones es cuatro, cinco, seis o siete, usted determina la valencia restando el número de electrones de 8. Eso es porque es más fácil para el átomo o la molécula aceptar electrones para lograr la estabilidad. Todos los gases nobles, excepto el helio, tienen ocho electrones en sus capas más externas y son químicamente inertes. El helio es un caso especial: es inerte, pero solo tiene dos electrones en su capa más externa.
La tabla periódica
Los científicos han organizado todos los elementos que se conocen actualmente en un cuadro llamado tabla periódica y, en muchos casos, puede determinar la valencia mirando el gráfico. Por ejemplo, todos los metales de la columna 1, incluidos el hidrógeno y el litio, tienen una valencia de +1, mientras que todos los de la columna 17, incluidos el flúor y el cloro, tienen una valencia de -1. Los gases nobles en la columna 18 tienen una valencia de 0 y son inertes.
No puede encontrar la valencia de cobre, oro o hierro utilizando este método porque tienen múltiples capas de electrones activos. Esto es cierto para todos los metales de transición en las columnas 3 a 10, los elementos más pesados en las columnas 11 a 14, los lantánidos (elementos 57-71) y los actínidos (elementos 89-103). Determinación de la valencia a partir de fórmulas químicas
Puede determinar la valencia de un elemento de transición o un radical en un compuesto particular observando cómo se combina con elementos con valencia conocida. Esta estrategia se basa en la regla del octeto, que nos dice que los elementos y los radicales se combinan para producir una capa externa estable de ocho electrones.
Como simples ilustraciones de esta estrategia, tenga en cuenta que el sodio (Na), con una valencia de +1, se combina fácilmente con cloro (Cl), que tiene una valencia de -1, para formar cloruro de sodio (NaCl) o sal de mesa. Este es un ejemplo de una reacción iónica en la cual un electrón es donado por un átomo y aceptado por el otro. Sin embargo, se necesitan dos átomos de sodio para combinarse iónicamente con azufre (S) para formar sulfuro de sodio (Na 2S), una sal fuertemente alcalinizante utilizada en la industria de la pulpa. Debido a que se necesitan dos átomos de sodio para formar este compuesto, la valencia del azufre debe ser -2. Para aplicar esta estrategia a moléculas más complejas, es importante darse cuenta primero de que los elementos a veces se combinan para formar radicales reactivos que tienen Todavía se ha logrado una capa exterior estable de ocho electrones. Un ejemplo es el radical sulfato (SO 4). Esta es una molécula tetraédrica en la cual el átomo de azufre comparte electrones con cuatro átomos de oxígeno en lo que se llama un enlace covalente. En dicho compuesto, no se puede derivar la valencia de los átomos en el radical al observar la fórmula. Sin embargo, puede determinar la valencia del radical por los compuestos iónicos que forma. Por ejemplo, el radical sulfato se combina iónicamente con hidrógeno para formar ácido sulfúrico (H 2SO 4). Esta molécula contiene dos átomos de hidrógeno, cada uno con una valencia conocida de +1, por lo que en este caso, la valencia del radical es -2. Una vez que haya determinado la valencia del radical, puede usarla. para calcular la valencia de otros elementos y moléculas con las que se combina. Por ejemplo, el hierro (Fe) es un metal de transición que puede exhibir múltiples valencias. Cuando se combina con el radical sulfato para formar sulfato ferroso, FeSO 4, su valencia debe ser +2, porque la valencia del radical sulfato, determinada por el enlace que forma con hidrógeno, es -2.