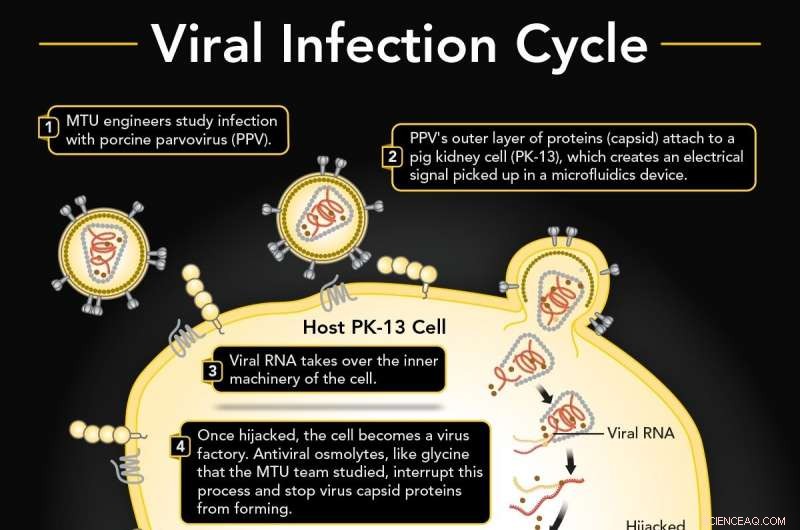
1. El parvovirus porcino (PPV) infecta una célula de riñón de cerdo (PK-13). 2. PPV se adhiere a PK-13 utilizando su capa externa de proteínas (cápside), que se puede detectar en un dispositivo de microfluidos. 3. El ARN viral secuestra la maquinaria interna de la célula para producir más virus. 4. Es probable que la glicina osmolita antiviral interrumpa la formación de la cápside. 5. Si es ininterrumpido, las réplicas virales atraviesan la membrana celular. 6. Hay un cambio en la señal eléctrica si hay glicina presente que es diferente de una célula infectada normal. Crédito:Universidad Tecnológica de Michigan
Un virus se adhiere a una célula, abre la cerradura y entra, luego toma el control de la producción genética y bombea muchas versiones de sí mismo que explotan a través de la pared celular.
Consigue tus palomitas de maíz. Los ingenieros y virólogos tienen una nueva forma de observar la desaparición de las infecciones virales.
La técnica utiliza microfluidos:el control submilimétrico de fluidos dentro de un estructura geométrica. En lo que es básicamente un portaobjetos de microscopio trucado, Los ingenieros químicos de la Universidad Tecnológica de Michigan han podido manipular virus en un dispositivo de microfluidos utilizando campos eléctricos. El estudio, publicado este verano en Langmuir , analiza los cambios en la membrana celular y brinda a los investigadores una idea más clara de cómo funcionan los antivirales en una célula para detener la propagación de la infección.
La infección viral comienza con la cápside
Los virus transportan una capa externa de proteínas llamada cápside. Las proteínas actúan como una ganzúa, adherirse y hacer palanca para abrir la membrana de una célula. Luego, el virus secuestra el funcionamiento interno de la célula, obligándolo a producir en masa el material genético del virus y construir muchos, muchas réplicas virales. Al igual que los granos de palomitas de maíz que empujan la tapa de una olla demasiado llena, los nuevos virus atraviesan la pared celular. Y el ciclo continúa con más ganchos de virus sueltos.
"Cuando observa las técnicas tradicionales, el etiquetado fluorescente para diferentes etapas, imagen verificar la viabilidad:el punto es saber cuándo la membrana está comprometida, "dijo Adrienne Minerick, coautor del estudio, decano de la Facultad de Informática y profesor de ingeniería química. "El problema es que estas técnicas son una medida indirecta. Nuestras herramientas miran la distribución de cargos, por lo que se centra en gran medida en lo que sucede entre la membrana celular y la superficie del virus. Descubrimos con mayor resolución cuándo el virus entra realmente en la célula ".
Dielectroforesis:conversación cargada
Observar el ciclo de la infección viral y monitorear sus etapas es crucial para desarrollar nuevos medicamentos antivirales y comprender mejor cómo se propaga un virus. La dielectroforesis ocurre cuando las células polarizables son empujadas en un campo eléctrico no uniforme. El movimiento de estas células es útil para diagnosticar enfermedades, tipificación de sangre, estudiar el cáncer y muchas otras aplicaciones biomédicas. Cuando se aplica al estudio de la infección viral, es importante tener en cuenta que los virus tienen una carga superficial, así que dentro del espacio confinado en un dispositivo de microfluidos, La dielectroforesis revela la conversación eléctrica entre la cápside del virus y las proteínas de la membrana celular.
"Estudiamos la interacción entre el virus y la célula en relación con el tiempo utilizando dispositivos de microfluidos, "dijo Sanaz Habibi, quien dirigió el estudio como estudiante de doctorado en ingeniería química en Michigan Tech. "Demostramos que podíamos ver interacciones entre virus y células dependientes del tiempo en el campo eléctrico".
Ver una infección viral en tiempo real es como un cruce entre una película de terror de zombis, Secado de pintura y repetición de una epopeya de Bollywood. Las células del dispositivo de microfluidos bailan alrededor, cambiando a patrones distintos con una pista musical dieléctrica. Es necesario que exista la proporción correcta de virus por células para ver cómo ocurre la infección, y no ocurre rápidamente. El experimento de Habibi se ejecuta en turnos de 10 horas, siguiendo las escenas iniciales de apego viral, un largo interludio de intrusión, y, finalmente, el trágico final cuando estallaron los nuevos virus, destruyendo la célula en el proceso.
Antes de que estallen las membranas celulares forman estructuras llamadas ampollas, que cambian la señal eléctrica medida en el dispositivo de microfluidos. Eso significa que las mediciones de dielectroforesis otorgan una comprensión de alta resolución de los cambios eléctricos que ocurren en la superficie de la celda durante todo el ciclo.
Entra en el Osmolyte
Las infecciones virales son lo más importante en este momento, pero no todos los virus son iguales. Si bien los dispositivos de microfluidos que usan dielectroforesis algún día podrían usarse para uso in situ, pruebas rápidas para enfermedades virales como COVID-19, el equipo de Michigan Tech se centró en un virus bien conocido y estudiado de cerca, el parvovirus porcino (PPV), que infecta las células renales en cerdos.
Pero luego el equipo quería ir más allá:agregaron la glicina osmolita, una importante intervención que sus colaboradores estudian en química de superficies virales y desarrollo de vacunas.
"Usando nuestro sistema, podríamos mostrar un comportamiento dependiente del tiempo del virus y la membrana celular. Luego agregamos el osmolito, que puede actuar como un compuesto antiviral, "Habibi explicó." Pensamos que detendría la interacción. En lugar de, parecía que la interacción continuaba ocurriendo al principio, pero luego los nuevos virus no pudieron salir de la célula ".
Esto se debe a que la glicina probablemente interrumpe la formación de la nueva cápside para los virus replicados dentro de la propia célula. Si bien esa parte específica de la danza viral ocurre detrás de la cortina de la pared celular, las mediciones dieléctricas muestran un cambio entre un ciclo infectado donde ocurre la formación de la cápside y una célula infectada donde la formación de la cápside es interrumpida por la glicina. Esta diferencia en la carga eléctrica indica que la glicina evita que los nuevos virus formen cápsides y evita que los posibles ladrones de cerraduras virales alcancen sus objetivos.
"Cuando trabajas con partículas y organismos tan pequeños, cuando puede ver este proceso en tiempo real, es gratificante hacer un seguimiento de esos cambios, "Habibi dijo.
Esta nueva visión de las interacciones entre las cápsides de los virus y las membranas celulares podría acelerar las pruebas y la caracterización de los virus. eliminando la costosa y lenta tecnología de imágenes. Quizás en una futura pandemia, habrá un punto de atención, dispositivos portátiles para diagnosticar infecciones virales y podemos esperar que los laboratorios médicos estén equipados con otros dispositivos de microfluidos que puedan detectar y revelar rápidamente los medicamentos antivirales más efectivos.