Crédito:Wiley
Las tasas de conversión impresionantemente altas de las enzimas naturales resultan en parte del aumento de la actividad catalítica de unas pocas cadenas laterales de aminoácidos seleccionadas a través de un posicionamiento preciso dentro de la cavidad de unión a proteínas. Los científicos han demostrado ahora que este ajuste fino también es posible para las enzimas "de diseño" con aminoácidos catalíticos no naturales. En el diario Angewandte Chemie , informan que la "evolución" en el laboratorio de una enzima de diseño con una cadena lateral de anilina condujo a variantes con una actividad significativamente mayor.
La velocidad y la selectividad con las que las enzimas en la naturaleza catalizan las conversiones son envidiables. Para impulsar catalíticamente reacciones no naturales, los investigadores imitan las enzimas con la ayuda de estructuras proteicas realizadas por el diseño de proteínas asistido por computadora. Se logra una mayor optimización mediante la repetición de un ciclo darwiniano:1) diversificación mediante mutación, 2) identificación de catalizadores mejorados, y 3) amplificación de las variantes enzimáticas más eficaces. Esto permite la producción de enzimas de diseño con actividades muy elevadas.
Investigadores dirigidos por Clemens Mayer y Gerard Roelfes en la Universidad de Groningen (Países Bajos) han demostrado ahora que este tipo de evolución dirigida es también un método para mejorar la eficiencia de una nueva clase de enzimas de diseño:las enzimas que contienen un aminoácido que es no utilizado por la naturaleza.
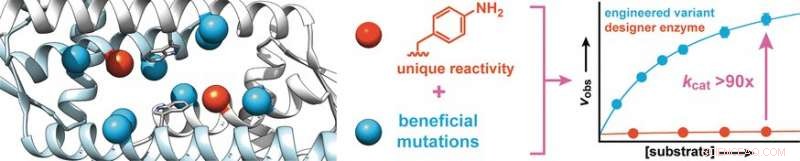
Comenzando con una proteína de Lactococcus lactis, una bacteria utilizada en la producción de productos lácteos como queso y suero de leche, los investigadores sintetizaron una enzima de diseño que contiene un aminoácido con una cadena lateral de anilina abiótica (aminofenilalanina). Como anilina gratis este aminoácido cataliza la reacción de aldehídos con hidrazinas o hidroxilaminas para producir hidrazonas u oximas, respectivamente.
Para aumentar la actividad de la enzima, los investigadores produjeron variantes de enzimas con mutaciones en los aminoácidos cerca de la cadena lateral de la anilina. El cribado de aproximadamente 400 mutantes produjo dos candidatos con mejor actividad, uno de los cuales fue sometido a una segunda ronda evolutiva. Esto llevó al descubrimiento de mutaciones más beneficiosas. Para identificar efectos sinérgicos, se combinaron múltiples mutaciones favorables para producir más variantes. De este modo, fue posible aumentar la tasa de conversión de la enzima en un factor de 90.
Los investigadores enfatizan que, similar a las enzimas naturales, "Este aumento drástico se basa en el fortalecimiento de la actividad catalítica inherente de la cadena lateral de la anilina. Tenemos la intención de utilizar este principio para incorporar más catalizadores orgánicos como cadenas laterales en las enzimas, y utilizar la evolución dirigida para convertirlos en enzimas de diseño altamente efectivas que puedan llevar a cabo de manera rápida y eficiente reacciones sintéticamente importantes que, de otro modo, solo se ejecutarían muy lentamente ".