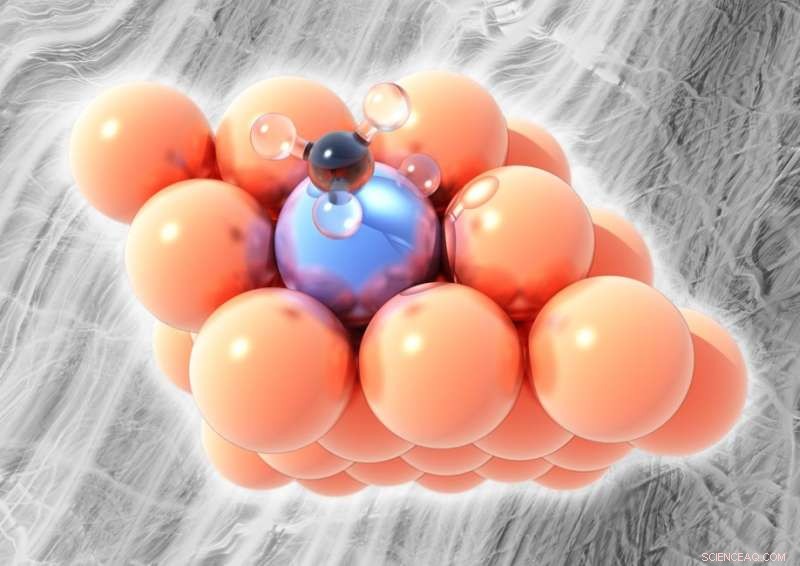
En la foto, la aleación de un solo átomo de platino-cobre. El cobre (naranja) no puede romper los enlaces entre el carbono (negro) y el hidrógeno (transparente) en los derivados del metano, excepto a temperaturas más altas. pero un solo átomo de platino (azul hielo) en la capa superficial de la aleación puede romper los átomos de hidrógeno a temperaturas relativamente bajas sin formar coque. Crédito:Michail Stamatakis, UCL
Los avances tecnológicos en la estimulación de pozos de petróleo y gas durante la última década ahora permiten la producción de gas natural a partir del gas de esquisto atrapado en formaciones rocosas subterráneas. Con el repentino aumento de la disponibilidad de gas de esquisto, los científicos han recuperado el interés en la activación de carbono-hidrógeno (C-H), el proceso de romper los enlaces C – H de gases como el metano para formar cadenas de hidrocarburos que pueden usarse como combustible.
Pero los científicos están muy lejos de extraer estos combustibles del gas de esquisto:la mayoría de los catalizadores para la activación de C – H rompen demasiados átomos de hidrógeno, dejando atrás un sólido de carbono no deseado llamado coque.
Deseando una aleación de metal que funcione como catalizador para la activación de C – H sin dejar de ser resistente al coque, un equipo dirigido por Charles Sykes en la Universidad de Tufts concibió una aleación hecha del metal reactivo platino y el metal inerte de cobre. En una serie de experimentos de laboratorio, El equipo de Sykes examinó el cobre puro, platino puro, y una aleación de un solo átomo de platino-cobre (SAA) para determinar las interacciones de cada material con los hidrocarburos derivados del metano, moléculas que se encuentran naturalmente en el gas de esquisto. El equipo descubrió que el SAA de platino-cobre era resistente a la coquización.
Tras este descubrimiento, El grupo de Catálisis Computacional Multiescala y Ciencia de Materiales dirigido por Michail Stamatakis en el University College London utilizó los recursos de computación de alto rendimiento (HPC) en Oak Ridge Leadership Computing Facility (OLCF) para desenmascarar los detalles de los experimentos a través de simulaciones. Matthew Darby, un postdoctorado en ese momento y ahora ganador del premio de doctorado del Consejo de Investigación de Ingeniería y Ciencias Físicas del Reino Unido trabajando en el grupo Stamatakis, realizó los cálculos para el proyecto.
Darby descubrió que a bajas temperaturas, el platino elimina rápidamente los hidrógenos del metano, que conduce a la formación de depósitos de carbono; el cobre no puede romper los enlaces C – H excepto a altas temperaturas. La aleación de platino y cobre del equipo, sin embargo, se descubrió que rompe eficazmente los enlaces C – H a temperaturas intermedias sin formar coque. Como cobre puro, la aleación también pudo formar cadenas de dos y tres moléculas de metano, y pudo lograrlo a una temperatura más de 100 grados Celsius más fría de lo que requería el cobre.
"Estos cálculos son muy costosos computacionalmente. Para algunos, si los ejecutó en su computadora portátil, puede llevar varios meses ejecutar un cálculo, "Dijo Darby." En el OLCF, puede llevar uno o dos días porque tiene cientos de núcleos con los que trabajar ".
Potentes supercomputadoras en el OLCF, una instalación para usuarios de la Oficina de Ciencias del Departamento de Energía de EE. UU. ubicada en el Laboratorio Nacional Oak Ridge del DOE, resolver problemas científicos complejos en energía, materiales química, y muchos otros dominios científicos. Los resultados de las simulaciones del equipo explican las reacciones del platino y el cobre con el metano y ofrecen un nuevo catalizador resistente al coque.
Armados con este nuevo conocimiento, los experimentadores de Tufts crearon una réplica a nivel micro del rendimiento de una planta química real para obtener aún más información sobre el proceso. El proyecto demuestra que la teoría se puede utilizar para perfeccionar experimentos proporcionando una comprensión fundamental, preparando el escenario para un trabajo experimental a mayor escala.
Un problema de coquización
Los combustibles comunes que existen como cadenas de moléculas de hidrocarburos incluyen propano, se utiliza a menudo en hornos para calentar, y butano, el líquido que se encuentra en la mayoría de los encendedores. Usando la activación C – H, los científicos pueden impulsar reacciones dentro del hidrocarburo más simple, el metano, y así alentar a estas moléculas a unirse para formar combustibles útiles. Debido a que las formaciones de lutitas son abundantes y fuentes de hidrocarburos más largos (por ejemplo, petróleo crudo) se están agotando, Los científicos están buscando formas de convertir metano catalíticamente en estos combustibles.
Los metales de transición como el platino y el níquel son catalizadores eficaces, pero también provocan la formación de grandes cantidades de depósitos de coque obstructivos. Esta capa de carbono recubre la parte superior del metal, haciendo que las moléculas de metano restantes no puedan reaccionar con el resto del material metálico.
"El coque es un gran problema en la química industrial, "Dijo Darby." Una vez que esté depositado, tienes que sacar tu metal del reactor, límpialo y volver a colocarlo. Eso implica cerrar la planta química gigante o calentar el metal a temperaturas peligrosamente altas ".
Contrariamente a su capacidad para separar rápidamente los hidrógenos del metano, el platino y el níquel tienen limitaciones para producir hidrocarburos de cadena más larga debido a la coquización. Recientemente, los científicos han buscado aleaciones hechas de un metal activo como el platino o el níquel y un metal inerte como el cobre o la plata. Pero incluso con este tipo de aleaciones, la coquización ha seguido planteando un problema.
El equipo de Sykes desarrolló un nuevo SAA, o aleación de un solo átomo, con solo 1 átomo de platino por cada 100 átomos de cobre, para combatir la coquización. Los átomos de platino se aislaron en la capa superficial del metal para garantizar que no reaccionaran demasiado. Los experimentos mostraron que los átomos de platino individuales en el cobre todavía reaccionan para romper los enlaces C – H, pero no hasta el punto en que se forma coque.
Darby luego simuló platino puro, cobre puro, y el SAA para determinar a cuál de las tres superficies se une un átomo de carbono con más fuerza. Repitió este proceso con carbono unido a uno, dos, Tres, y cuatro hidrógenos, así como átomos de hidrógeno por sí solos. Descubrió que estas moléculas se unen al cobre con mayor afinidad que al platino, y se requiere mucha más energía para que el cobre rompa los enlaces C – H. Los resultados son clave para explicar por qué el cobre es un catalizador ineficaz.
"El platino puede romper los enlaces C – H millones de veces más rápido que el cobre, y la aleación está en algún punto intermedio, "Dijo Darby." Antes de este SAA, las personas no podían unir dos o tres moléculas de metano a bajas temperaturas sin desactivar el metal. Hemos demostrado que podemos obtener hasta tres ".
El hallazgo es importante porque nunca antes había habido una aleación que pudiera romper de manera efectiva los enlaces C – H y también seguir siendo resistente al coque.
"Nuestro SAA demuestra que una solución a este problema podría ser posible, ", Dijo Darby." Espero que esto ayude a estimular a la comunidad química a probar más combinaciones de SAA y ver si realmente podemos encontrar la aleación que será perfecta para esto ".
Partículas del tamaño de un átomo
Las simulaciones se realizaron en recursos OLCF utilizando el Paquete de simulación ab initio de Viena (VASP), un código diseñado para modelar materiales a escala atómica. VASP es el más popular de su tipo y está perfectamente adaptado para su uso en computadoras paralelas de alto rendimiento como las del OLCF.
"Modelamos las cosas a nivel de átomo, "Dijo Darby." Modelamos 100 partículas del tamaño de un átomo:el catalizador y las moléculas de metano. Luego calculamos cuánta energía se necesita para convertir el metano en otra cosa ".
Al comparar estos cálculos entre sí, Darby pudo explicar los hallazgos experimentales. Al reproducir todo en el experimento, el equipo pudo ver hasta el nivel del átomo y simular la cantidad de veces que se romperían enlaces específicos, algo que es imposible de contar en un experimento.
La esperanza del equipo es que algún día una aleación pueda unir hasta ocho metanos (el octano compuesto), que luego se puede utilizar para alimentar automóviles. Los resultados del proyecto y el trabajo en curso del grupo Stamatakis permitirán a los experimentadores centrarse en los sistemas de aleaciones más importantes en lugar de probar sistemas aleatorios.
"Con el experimento, es principalmente prueba y error, "Dijo Darby." Las simulaciones nos dan una hoja de ruta ".