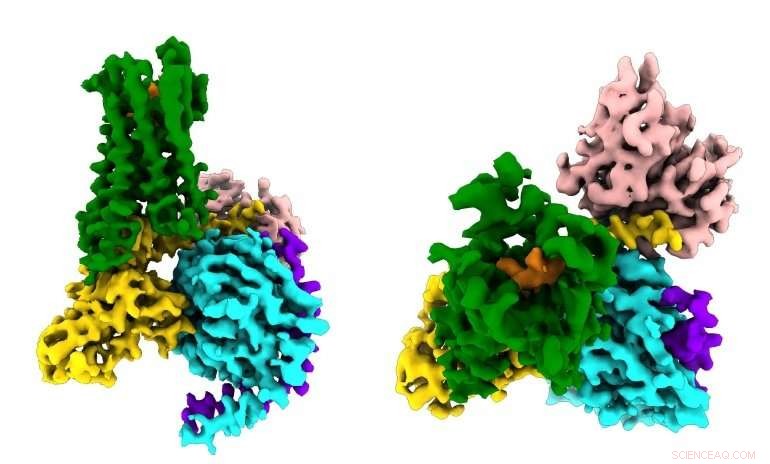
Los investigadores ven por primera vez cómo un fármaco opioide sintético (naranja) se une a los receptores opioides µ (verde) en el cerebro, y activar moléculas de señalización dentro de las neuronas (G⍺s en oro, Gβ en cian, Gγ en púrpura) que conducen a la supresión del dolor y la adicción. Crédito:Antoine Koehl (laboratorio de Manglik)
Los medicamentos opioides como la morfina y el fentanilo son un pilar de los analgésicos modernos. Pero también provocan estreñimiento, son muy adictivos, y puede provocar insuficiencia respiratoria mortal si se toma en una dosis demasiado alta. Los científicos han buscado durante mucho tiempo desarrollar nuevos medicamentos opioides que puedan aliviar el dolor sin estos peligrosos efectos secundarios. pero los agujeros en nuestra comprensión de cómo los opioides ejercen sus diversos efectos a nivel biológico hasta ahora han mantenido a raya este sueño.
Los analgésicos opioides actúan uniéndose a una proteína receptora presente en las células nerviosas llamada receptor opioide µ. que evolucionó para responder a los analgésicos naturales del cuerpo (como las endorfinas producidas por el ejercicio) atenuando el dolor y creando una sensación de euforia. Las drogas opioides, desde el opio hasta la morfina y la heroína, secuestran este sistema de señalización al unirse a la misma molécula receptora. Pero los detalles de cómo la activación de estos receptores desencadena los efectos positivos y negativos de las drogas siguen siendo confusos.
Ahora, en un estudio publicado el 13 de junio, 2018 en Naturaleza , Los científicos de la UC San Francisco y la Universidad de Stanford han utilizado microscopía crioelectrónica de ultra alta resolución (cryoEM) para capturar el retrato más detallado de un fármaco opioide que desencadena la cascada de señalización bioquímica que le da su poder, tanto para bien como para mal. .
"Básicamente, hemos capturado este evento de señalización en el acto, "dijo el coautor principal del estudio, Aashish Manglik, MARYLAND, Doctor., profesor asistente de química farmacéutica en la Facultad de Farmacia de UCSF que realizó el nuevo estudio como estudiante graduado y miembro distinguido en Stanford. "Es de esperar que estas nuevas imágenes a nivel atómico nos permitan diseñar de manera racional compuestos que se dirijan a diferentes aspectos de la señalización de opioides en el cerebro". con la esperanza de identificar nuevos, analgésicos más seguros ".
El receptor de opioides µ es parte de una gran familia de cientos de proteínas de señalización llamadas receptores acoplados a proteína G (GPCR) que están involucrados en todo, desde la visión y la audición hasta la respuesta del sistema inmunológico a los patógenos invasores, y son el objetivo de más del 30 por ciento de las drogas modernas. La mayoría de los GPCR comparten los mismos mecanismos básicos:cuando la molécula de señalización correcta (por ejemplo, un opioide) se une a un GPCR en el exterior de la célula, la proteína estimula una reacción en cadena de señales bioquímicas dentro de la célula activando una molécula mensajera llamada proteína G (de ahí el nombre GPCR).
Los experimentos que revelaron cómo un tipo diferente de GPCR se une a la proteína G "estimulante" llevaron a un Premio Nobel para Brian Kobilka de Stanford. MARYLAND, uno de los autores principales del nuevo estudio, pero los investigadores han sabido durante décadas que los GPCR también pueden unirse a hasta una docena de otras moléculas de señalización dentro de la célula. Por ejemplo, Los receptores µ-opioides normalmente solo activan las denominadas proteínas G "inhibidoras", que tienen el efecto opuesto de la cascada de proteína G estimulante. Sin embargo, los científicos no están seguros de qué causa la afinidad de algunos GPCR por proteínas asociadas particulares dentro de la célula, o exactamente cuáles son las consecuencias.
Los investigadores esperan que al comprender estas diferentes vías de señalización GPCR, pueden ser capaces de desarrollar fármacos con efectos muy específicos, como suprimir el dolor sin causar adicción. Pero hasta ahora los investigadores tenían poca idea de cómo un GPCR determinado interactúa selectivamente con solo un subconjunto de socios de señalización dentro de la célula.
El nuevo estudio, publicado el 13 de junio de 2018 en Naturaleza , capturó por primera vez cómo el receptor opioide µ se une a su pareja inhibidora de proteína G. Entre otros hallazgos, El estudio mostró que la selectividad del receptor parece deberse al pequeño tamaño del bolsillo de unión de la proteína G en el interior de la célula. mientras que la proteína G estimulante requiere un sitio de unión más grande.
Manglik colaboró previamente con el laboratorio computacional de descubrimiento de fármacos de Brian Shoichet, Doctor., profesor de química farmacéutica en la Facultad de Farmacia de UCSF, para identificar una molécula llamada PZM21 que permite que el receptor µ-opioide solo active la proteína G inhibitoria pero no otra molécula de señalización llamada beta-arrestina, y demostró que este fármaco selectivo proporcionó alivio del dolor con efectos secundarios reducidos en ratones. Su laboratorio ahora se basa en lo nuevo, retrato de alta resolución del receptor opioide - complejo de proteína G para desarrollar nuevos, compuestos aún más selectivos.