Los aminoácidos, como la tirosina y el triptófano, son los componentes fundamentales que forman las proteínas. Estas biomoléculas tienen diferentes grupos químicos en cada extremo y cadena lateral, por lo que tienen la capacidad natural de formar una cadena mediante la formación de un enlace amida (péptido). Sin embargo, dichos vínculos son débiles y se degradan fácilmente en condiciones fisiológicas. Aquí es donde los aminoácidos protegidos por Fmoc entran en escena.
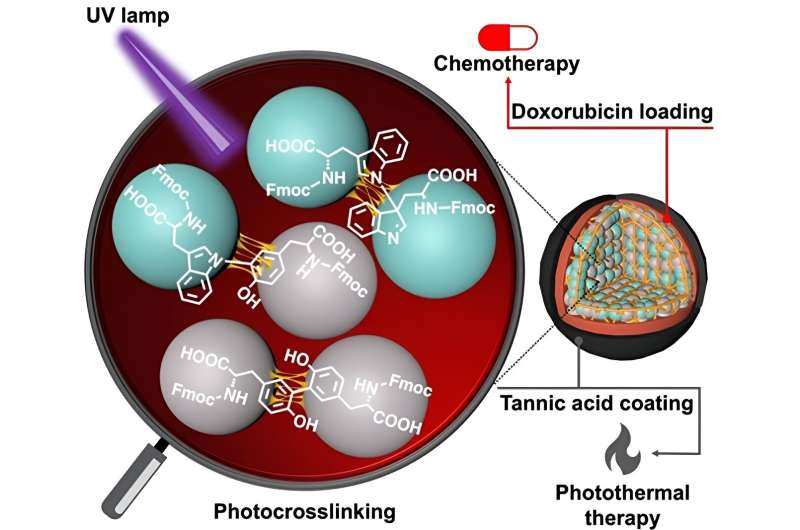
En un nuevo estudio realizado ahora, un equipo de investigación dirigido por el Dr. Eijiro Miyako, profesor asociado del Instituto Avanzado de Ciencia y Tecnología de Japón (JAIST), y el Dr. Alberto Bianco y la Dra. Cécilia Ménard-Moyon del Centro Nacional de la Investigación Científica ( CNRS), Francia, empleó luz ultravioleta a 254 nm (que da lugar a nanopartículas CBPUV) y reticulación mediada por riboflavina a 365 nm (que da lugar a nanopartículas CBPRibo) para reticular los aminoácidos protegidos por Fmoc.
"Los aminoácidos, al ser los componentes básicos de las proteínas, tienen numerosas ventajas, como una mejor biocompatibilidad. Por lo tanto, queríamos crear nuevas nanopartículas autoensambladas basadas en aminoácidos que puedan activarse a través de múltiples mecanismos", dice el Dr. Eijiro Miyako. Los hallazgos de este estudio se publican en Small .
Los aminoácidos autoensamblados eran dímeros reticulados de forma estable de Fmoc-Tyr-OH (tirosina) y Fmoc-Trp-OH (triptófano). Posteriormente se cargó doxorrubicina, un fármaco contra el cáncer, en las nanopartículas de aminoácidos reticulados.
Para aumentar la estabilidad de las nanopartículas, los investigadores utilizaron un ácido tánico-hierro (Fe 3+ ) complejo (o TAF) como capa exterior de recubrimiento. Este recubrimiento puede degradarse dentro de las células mediante la liberación enzimática de glutatión o por la diferencia de pH en el microambiente del tumor. El recubrimiento de ácido tánico también se puede utilizar en terapia fototérmica contra el cáncer, donde la luz externa puede aumentar la temperatura local que rodea el tejido canceroso, provocando la muerte de las células cancerosas.
Luego, las nanopartículas sintetizadas se estudiaron exhaustivamente para determinar su integridad estructural, estabilidad y liberación de fármacos en diferentes condiciones de pH. Luego se estudiaron el perfil funcional, la absorción celular y la biocompatibilidad de las nanopartículas de aminoácidos autoensambladas utilizando técnicas de cultivo celular.
Finalmente, se analizó la eficacia anticancerígena de las nanopartículas sintetizadas en ratones portadores de tumores. El enfoque combinado de quimioterapia, debido a la acción de la doxorrubicina, y terapia fototérmica gracias a la capa de ácido tánico, mostró una excelente actividad anticancerígena.
Después de la reticulación, las nanopartículas a base de aminoácidos mostraron cambios notables en color, tamaño, absorbancia, fluorescencia y estabilidad térmica. Además, CBPUV exhibió una estabilidad superior después de la reticulación, en comparación con CBPRibo. CBPUV también mantuvo consistentemente su estructura, mientras que CBPRibo mostró un desmontaje parcial, formando esferas huecas.
El estudio de liberación del fármaco reveló una liberación mínima del fármaco con un pH fisiológico (7,4), lo que indica que el recubrimiento estable es crucial para la administración in vivo. A un pH de 5,5, la degradación incompleta del recubrimiento dio como resultado una liberación insignificante del fármaco. Sin embargo, la adición de glutatión (GSH) a pH 5,5 aumentó significativamente la liberación del fármaco al desencadenar la degradación del recubrimiento de TAF, lo que indica capacidad de respuesta de GSH/pH.
El tratamiento combinado con ácido y GSH intensificó la degradación del recubrimiento. Este comportamiento de respuesta permite la liberación controlada del fármaco en condiciones fisiológicas específicas. Además, las evaluaciones in vitro revelaron citotoxicidad dependiente de la concentración y una eficacia mejorada en la terapia combinada de quimioterapia y fototermia. Los estudios in vivo en ratones con tumores mostraron una inhibición significativa del crecimiento tumoral, lo que indica efectos anticancerígenos prometedores sin efectos secundarios observados.
El Dr. Miyako dijo:"La nanotecnología promete transformar la ciencia básica de laboratorio en una poderosa herramienta para combatir enfermedades complejas como el cáncer. Somos optimistas de que esta investigación pionera avanzará y potencialmente evolucionará hacia una tecnología de vanguardia para el tratamiento del cáncer lista para ensayos clínicos dentro de diez años". años."
En el futuro, el desarrollo de estas nanopartículas de aminoácidos autoensambladas puede ayudar a combatir problemas críticos como la resistencia a múltiples medicamentos en el cáncer y mejorar la eficacia general de los resultados del tratamiento.
Más información: Tengfei Wang et al, Nanopartículas de aminoácidos coensambladas fotorreticuladas para terapia anticancerígena combinada fototérmica/quimiocontrolada, pequeña (2023). DOI:10.1002/smll.202307337
Información de la revista: Pequeño
Proporcionado por el Instituto Avanzado de Ciencia y Tecnología de Japón