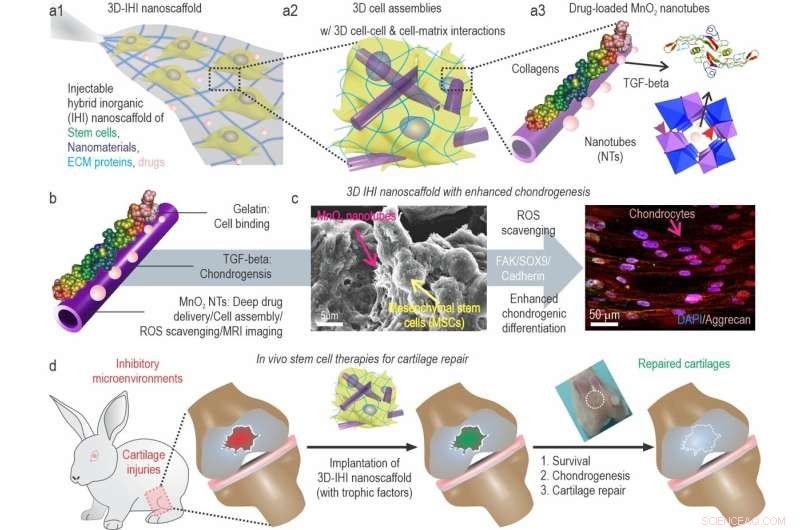
a) Una ilustración esquemática de 3D TGFβ-BMSC-IHI nanoscaffold. b) La ilustración esquemática de MnO2 recubierto de gelatina y cargado con TGF-β3 NT. c) La imagen FESEM indicó que la mayoría de las BMSC forman contactos con otras células y las estructuras similares a fibrillas 1D, que eran similares a las estructuras de los tejidos naturales. d) Al remodelar el microambiente oxidativo, mejorar la viabilidad celular y la condrogénesis de las células trasplantadas, finalmente podría lograrse la regeneración del cartílago. Crédito:Science China Press
Un estudio dirigido por el Prof. Qiuyu Zhang (Universidad Politécnica del Noroeste), el Prof. Ki-Bum Lee (Universidad de Rutgers) y el Prof. Liang Kong (Escuela de Estomatología, La Cuarta Universidad Médica Militar) ha establecido un inorgánico híbrido inyectable (IHI) ensamblaje de células madre con plantilla de nanoandamios y lo aplicó a la regeneración de defectos de cartílago de tamaño crítico.
Las lesiones del cartílago a menudo son devastadoras y la mayoría de ellas no tienen cura debido a la capacidad de regeneración intrínsecamente baja de los tejidos del cartílago. El auge de los sistemas de cultivo de células madre en 3D ha dado lugar a avances en la biología del desarrollo, el modelado de enfermedades y la medicina regenerativa. Por ejemplo, las células madre, una vez trasplantadas con éxito, inicialmente podrían secretar factores tróficos para reducir la inflamación en los sitios de lesiones del cartílago y luego diferenciarse en células de cartílago (p. ej., condrocitos) para la restauración funcional.
Sin embargo, quedan barreras críticas por superar antes de que se pueda realizar el potencial terapéutico de las terapias con células madre. El control limitado sobre la diferenciación condrogénica de las células madre in vivo a menudo ha resultado en resultados regenerativos comprometidos. Además, debido a la prevalencia del estrés oxidativo y la inflamación en el microambiente de los sitios de lesión, las células madre con frecuencia sufren apoptosis después de la inyección.
Para hacer frente a estos desafíos, los investigadores demostraron el desarrollo de un sistema de ensamblaje de células madre con plantilla de nanoandamios 3D IHI para el cultivo e implantación avanzados de células madre en 3D. 3D-IHI nanoscaffold ensambla rápidamente células madre en construcciones de tejido inyectable a través de interacciones célula-célula y célula-matriz 3D personalizadas, entrega de manera profunda y homogénea proteínas condrogénicas en los sistemas de cultivo 3D ensamblados e induce de forma controlada la condrogénesis a través de efectos nanotopográficos.
Una vez implantado in vivo en un modelo de lesión de cartílago de conejo, el nanoandamio 3D-IHI modula de manera efectiva el microentorno dinámico después de la lesión de cartílago a través de la integración de las señales regenerativas antes mencionadas y, al mismo tiempo, elimina las especies reactivas de oxígeno utilizando una composición a base de dióxido de manganeso. De esta forma, se logra una reparación acelerada de los defectos del cartílago con una reconstrucción tisular rápida y una recuperación funcional tanto a corto como a largo plazo. Dada la excelente versatilidad y el resultado terapéutico de la regeneración de cartílago basada en nanoestructuras 3D-IHI, puede proporcionar medios prometedores para avanzar en una variedad de aplicaciones de ingeniería de tejidos.
La investigación fue publicada en National Science Review .
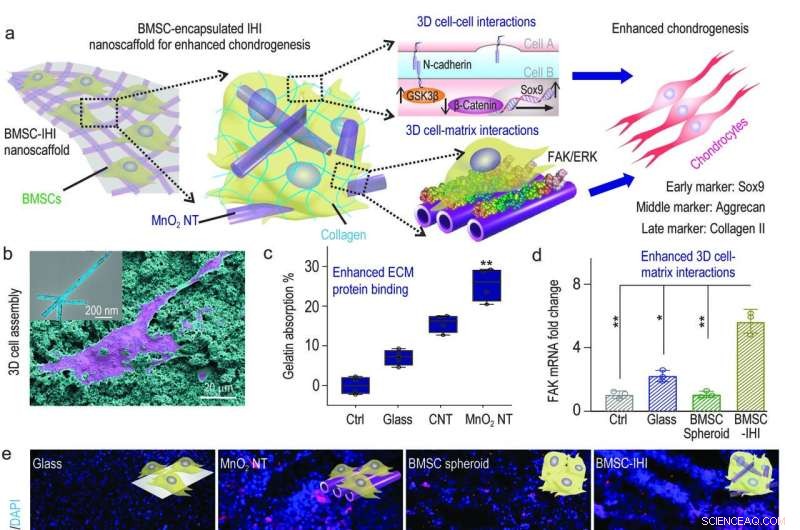
a) Un diagrama esquemático que muestra el nanoandamio 3D-IHI podría mejorar la diferenciación condrogénica de BMSC a través de una sinergia entre las vías mediadas por N-cadherina y FAK. b) Las fuertes interacciones entre MnO2 Los NT y los grupos funcionales que existen comúnmente en las proteínas ECM respaldaron de manera efectiva la unión celular, como se demostró a través de la imagen SEM. c) El ensayo de ácido bicinconínico indicó una mayor absorción hacia la gelatina a partir de MnO2 nanotubo en comparación con los grupos de control. d) El MnO2 nanotube-templated assembly method significantly enhanced cell-matrix interaction as demonstrated through the up-regulated expression patterns of the FAK gene. e) Representative immunostaining images showing the improved chondrogenesis of BMSC in the BMSC-IHI nanoscaffold group compared to the control groups. Scale bar:50 μm. f-h) The expression of chondrogenic genes, including SOX9 (f), Aggrecan (g), and Col-II (h) were characterized via qRT-PCR measurement. Crédito:Science China Press
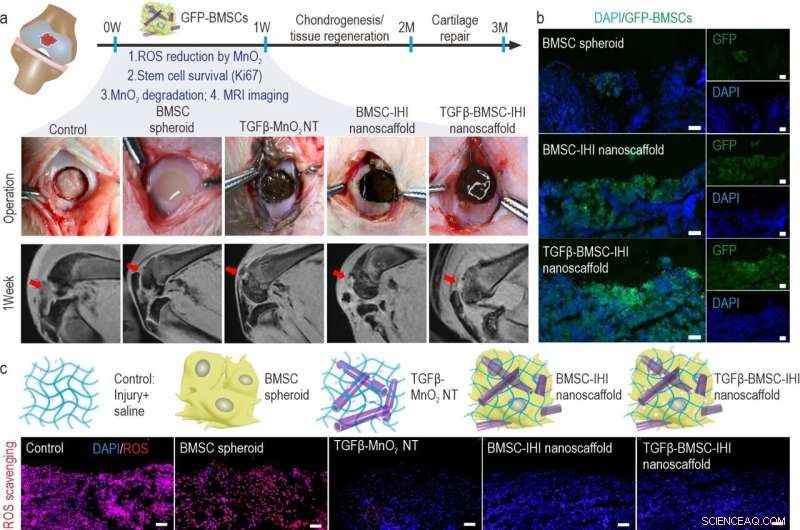
a) Schematic diagram illustrating the surgical process and timeline of cartilage repair. The degradation of MnO2 NTs and the regeneration process could be monitored via MRI. b) To identify our transplanted cells, BMSCs were genetically labeled with a green fluorescent protein (GFP). Scale bar:100 μm. c) The dramatically reduced red fluorescent signals of the ROS probe revealed that MnO2 NTs in the IHI nanoscaffold could effectively scavenge ROS in the defect area. Promoted cell proliferation was confirmed by the higher expression of proliferative marker Ki67 immunostaining. Scale bar:50 μm. d) The TGFβ-BMSC-IHI nanoscaffold could retain a significantly higher amount of cells after transplantation compared to other cell transplantation groups by quantifying the number of remaining GFP+ cells in (c). e) Histogram of the fluorescence intensity of ROS probe showed the effective consumption of ROS in the MnO2 NTs containing groups. f) Quantification of Ki67+ cells in the defects. The quantifications in (e) and (f) were generated based on the fluorescence intensities in (c). Crédito:Science China Press
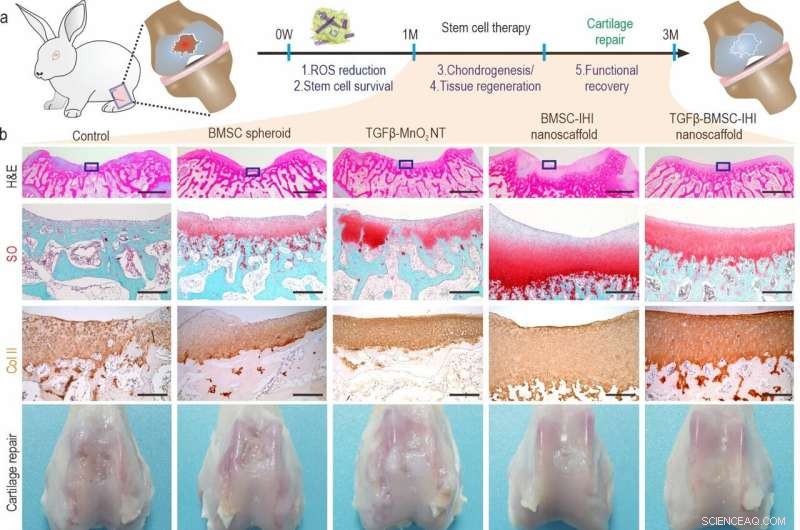
a) A schematic diagram illustrating the long-term (3 months) cartilage regeneration process. b) The in vivo cartilage regeneration was characterized through H&E, Safranin O staining, Col-II immunochemistry staining, as well as macroscopic views. Zoom out scale bar:2 mm, zoom in scale bar:200 μm. c-h) Quantifications of cartilage thickness (by H&E staining) (c), cellular components (by Safranin O staining) (d), ECM components (by Col II immunostaining) (e). Results of International Cartilage Repair Society (ICRS) macroscopic (f) and histologic scores (g) indicated significantly improved defect repair qualities in the TGFβ-BMSC-IHI nanoscaffold group. The reduced Osteoarthritis Research Society International (OARSI) scores revealed the TGFβ-BMSC-IHI nanoscaffold could prevent the deterioration of osteoarthritis (h). Crédito:Science China Press