Investigación intracelular de FRET NPD. Crédito:Universidad de Tohoku
La mayoría de los sistemas de administración de fármacos utilizan nanoportadores para transportar fármacos debido a su pequeño tamaño y su capacidad para distribuir fármacos a lugares del cuerpo que de otro modo serían inaccesibles. La desventaja de este pequeño tamaño, sin embargo, es que se necesitan grandes cantidades para igualar la dosis requerida.
Sistemas alternativos sin portadores, conocidos como nanoprofármacos (NPD), muestran una inmensa promesa para el tratamiento del cáncer. Por ejemplo, un SN-38 NPD tiene una eficacia anticancerosa aproximadamente 10 veces mayor que los fármacos disponibles comercialmente. Ahora, los investigadores tienen, por primera vez, desarrolló un estudio integral sobre la dinámica de los NPD SN-38 dentro de las células cancerosas, incluyendo su tasa de internalización, localización intracelular, y degradación, así como su eficacia terapéutica.
"Estos sistemas innovadores muestran una alta actividad anticancerígena, pero el conocimiento fundamental para la traducción clínica, como su interacción con las células cancerosas, todavía faltaba, "dijo el profesor Hitoshi Kasai, coautor del estudio.
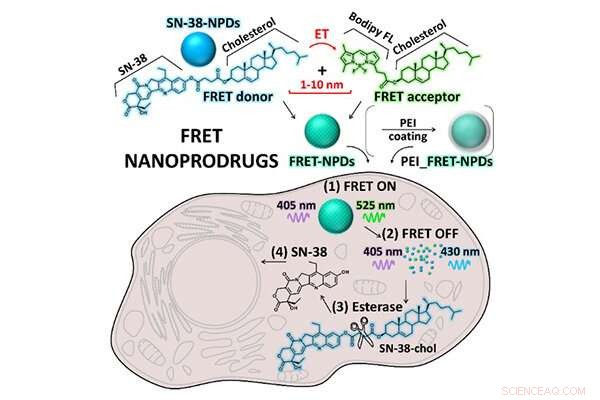
El equipo de investigación evaluó el estado de los NPD dentro de las células cancerosas utilizando la técnica de microscopía basada en la transferencia de energía por resonancia de Förster (FRET). FRET se basa en la transferencia de energía entre dos moléculas sensibles a la luz. Aprovechando la propiedad fluorescente del SN-38 junto con la sonda de fluorescencia Bodipy FL en los NPD diseñados específicamente para este estudio, FRET permitió a los investigadores observar el estado de los NPD desde la partícula intacta hasta el profármaco disuelto.
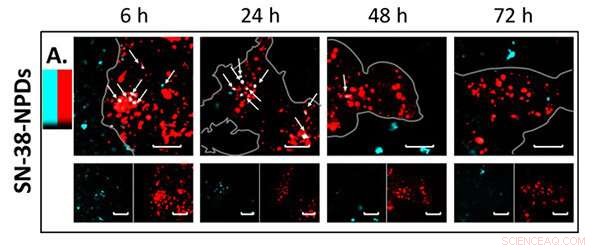
Imágenes de fluorescencia de NPD (en azul) que co-localizan y degradan dentro de los lisosomas (en rojo) con el tiempo. Crédito:Universidad de Tohoku
La observación de microscopía láser confocal confirmó una degradación significativa del NPD desde el estado intacto hasta un profármaco disuelto dentro de las células a lo largo del tiempo. Esto significa que los NPD fueron absorbidos constantemente por las células como partículas intactas antes de ser transportados a los lisosomas, un orgánulo unido a la membrana que contiene enzimas digestivas. Una vez dentro de los lisosomas, el profármaco SN-38 se disolvió a partir de una partícula intacta (Figura 2) y realizó sus efectos terapéuticos sobre las células cancerosas.
Kasai agrega que "Nuestros trabajos brindan una descripción completa de la dinámica de las nanopartículas de profármacos dentro de las células cancerosas, permitiendo un mayor progreso hacia su aplicación como dispositivos de administración de fármacos contra el cáncer de próxima generación ".