Crédito:Unsplash / CC0 Public Domain
En el cuerpo humano las proteínas a veces se encuentran en agregados fibrilares llamados amiloides. Aunque se sabe que ciertos amiloides tienen una función biológica, La formación de amiloide a menudo se asocia con patologías, incluidas las enfermedades de Alzheimer y Parkinson. Comprender cómo se forman exactamente las fibrillas de amiloide es crucial para comprender mejor el desarrollo de tales enfermedades y avanzar en los enfoques de tratamiento.
Ahora, Takahiro Watanabe-Nakayama de la Universidad de Kanazawa, Kenjiro Ono de la Universidad Showa, y sus colegas han investigado el proceso de formación de fibrillas de amiloide particulares utilizando una técnica que permite la visualización del crecimiento a lo largo del tiempo. Los científicos observaron específicamente el efecto de la siembra cruzada ('mezcla') de diferentes proteínas formando agregados, y encontró variaciones en las tasas de alargamiento y las estructuras de las fibrillas.
Los investigadores estudiaron la alfa-sinucleína, una proteína abundante en el cerebro humano. Observaron lo que sucedió al dejar que las moléculas de alfa-sinucleína de tipo salvaje, las naturales, variante más abundante:forman agregados, y también cómo la agregación es diferente cuando se introducen variantes mutantes (sembradoras) asociadas con la enfermedad de Parkinson. Además, los científicos examinaron la influencia del nivel de pH del microambiente en el que tiene lugar el crecimiento de las fibrillas.
Mediante microscopía de fuerza atómica de alta velocidad (HS-AFM), Watanabe-Nakayama, Ono y sus colegas pudieron registrar la agregación de fibrillas con una resolución nanométrica y una alta velocidad de video para varios casos. Primero, los científicos observaron el crecimiento de tipos de variantes únicas (auto-siembra). Descubrieron que los mutantes producían más agregados, o que se agregaron más rápidamente a pH neutro que las variantes de tipo salvaje. Otra observación fue que el alargamiento era más rápido a pH más bajo (5.8, es decir, ácido) que a un pH más alto (7,4, es decir, básico).
La microscopía de fuerza atómica de alta velocidad permite visualizar y analizar la formación de fibrillas de variantes de una sola proteína. Crédito:Universidad de Kanazawa
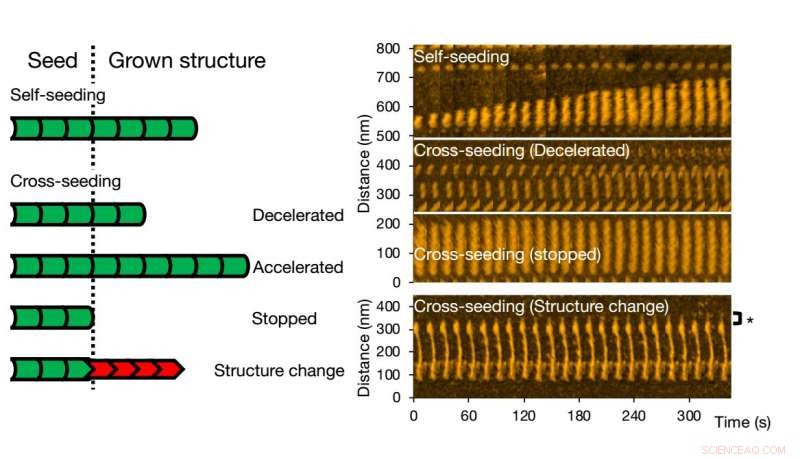
Para la siembra cruzada, Pueden ocurrir diferentes escenarios. El crecimiento de las fibrillas se puede acelerar o ralentizar, o incluso se detuvo. Se puede conservar la morfología de la semilla original, pero también sucede que la estructura de la fibrilla resultante es diferente; las formas estructurales típicas son "rectas" o "espirales". Los investigadores comprobaron que la estructura y la dinámica de las fibrillas observadas con HS-AFM corresponden a los procesos en solución mediante experimentos de fluorescencia; se obtuvieron conclusiones similares.
Los hallazgos de Watanabe-Nakayama, Ono y sus colegas son relevantes para comprender mejor las enfermedades relacionadas con los amiloides. Citando a los investigadores:"La siembra cruzada combinada con variaciones en las tasas de alargamiento tiene el efecto de aumentar la diversidad estructural de los ensamblajes resultantes. Esta diversidad puede reflejarse en distintos efectos neurotóxicos para varios ensamblajes [de proteínas]".