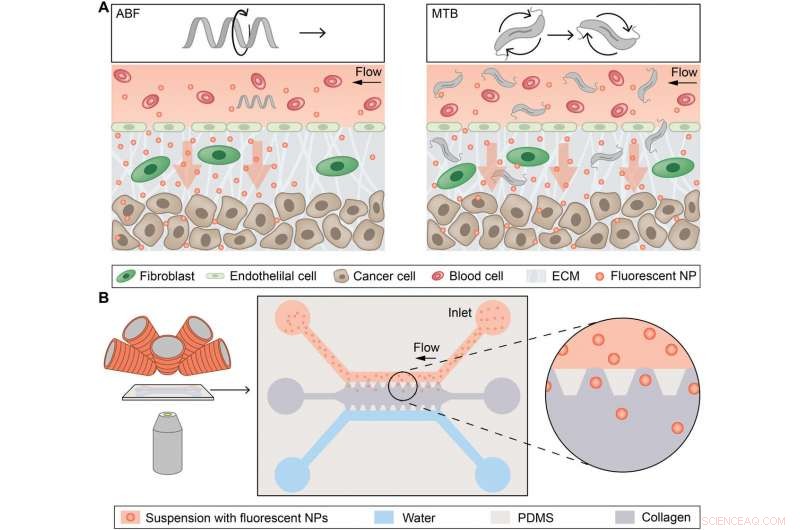
Descripción general conceptual de micropropulsores controlados magnéticamente para el transporte NP mejorado por convección. (A) Esquema conceptual que representa un solo microrobot, el flagelo bacteriano artificial (ABF), mejorar el transporte masivo de nanopartículas (NP) en la interfaz vaso-tejido (izquierda), y enjambres de bacterias magnetotácticas (MTB) que generan flujo convectivo para mejorar el transporte de masa (derecha). ECM, la matriz extracelular. (B) Esquema de la plataforma magnetofluídica para estudios de transporte de masa NP utilizando convección inducida magnéticamente. El chip de microfluidos se coloca entre la lente del objetivo de un microscopio óptico invertido y los electroimanes (izquierda). Un esquema muestra el chip, que consta de un canal superior lleno de NP (rojo) y un canal de agua inferior (azul) que bordean una matriz de colágeno (gris) junto con postes trapezoidales de restricción hechos de PDMS. Las NP pueden difundirse pasivamente en la matriz de colágeno a lo largo de su gradiente de concentración hacia el canal de agua. Crédito: Avances de la ciencia , doi:10.1126 / sciadv.aav4803
Las nanopartículas (NP) son una plataforma prometedora para la administración de medicamentos para tratar una variedad de enfermedades, incluido el cáncer, enfermedad cardiovascular e inflamación. Sin embargo, la eficacia de la transferencia de NP al tejido enfermo de interés es limitada debido a una variedad de barreras fisiológicas. Un obstáculo importante es el transporte de NP para alcanzar con precisión el tejido diana de interés. En un estudio reciente, S. Schuerle y un equipo de investigadores interdisciplinarios en los departamentos de Medicina Traslacional, Biofísica, Ingeniería Robótica, Nanomedicina y Electrónica, En Suiza, el Reino Unido y los EE. UU. desarrollaron dos micro-hélices distintas basadas en microrobot para abordar el desafío.
Utilizaron campos magnéticos giratorios (RMF) para alimentar los dispositivos y crear una convección de fluido local para superar el transporte de nanopartículas limitado por difusión. Durante el primer enfoque experimental, utilizaron un único microbot magnético sintético como flagelo bacteriano artificial (ABF) y luego utilizaron enjambres de bacterias magnetotácticas naturales (MTB) para crear un "ferrofluido vivo" mediante la explotación de la ferrohidrodinámica. Usando ambos enfoques, los científicos mejoraron el transporte de NP en un modelo microfluídico de extravasación de sangre (movimiento de un fármaco desde los vasos sanguíneos al tejido externo) y la penetración de tejido en microcanales rodeados por una matriz de colágeno para crear una interfaz biomimética tejido-vaso en el laboratorio. Los resultados del estudio ahora se publican en Avances de la ciencia .
Las nanopartículas (NP) son cada vez más populares en nanomedicina debido al potencial de la investigación biomédica como portadores en la administración de fármacos que superan los límites de la medicina convencional. Si bien los NP están diseñados para alterar la farmacocinética y la biodistribución de los medicamentos existentes, están impedidos por barreras fisiológicas, que previenen la acumulación exitosa en los sitios de la enfermedad, limitando sus efectos terapéuticos in vivo. Durante la terapia contra el cáncer, por ejemplo, Los portadores de fármacos encuentran vasos anormales que rodean la arquitectura del tumor para una liberación intravenosa ineficaz del fármaco.
Dado que la administración de NP a los tejidos está fuertemente influenciada por sus propiedades fisicoquímicas, Los científicos han rediseñado las formas y tamaños de los NP para optimizar su cinética de transporte a través de las paredes de los vasos para llegar a los tejidos. Los investigadores habían propuesto previamente enfoques de varias etapas para optimizar la administración de fármacos, ya sea reduciendo las nanopartículas a tiempo, o fragmentarlos para dispersarlos y alcanzar un sitio de interés solo después de encontrar señales microambientales de enfermedad in vivo.

El flagelo bacteriano artificial (ABF) en un dispositivo de flujo de un fluido similar a un microvaso. Crédito:Science Advances, doi:10.1126 / sciadv.aav4803
Generalmente, El transporte de NP se ve afectado por la carga superficial, hidrofobicidad y bioquímica de superficies; propiedades que pueden optimizarse activamente en el trabajo de investigación para un tráfico in vivo más eficaz. Los científicos han utilizado fuentes de energía externas, como fuerzas magnéticas y acústicas, para crear microbots controlados de forma inalámbrica y trasladar las terapias al tejido enfermo para mejorar el transporte difusivo. Sin embargo, estos métodos todavía dependían del transporte difusivo después de liberar su carga a bordo, mientras que persiste la necesidad de estrategias de transporte más distintas a un lugar definido.
En el presente trabajo, Schuerle y col. detalló dos estrategias distintas para generar flujo convectivo localizado de forma inalámbrica para prevenir la invasividad de las nanopartículas implantadas. Inspirado en el campo de los microrobots (microbots), los científicos usaron (1) un solo, sintético, microrobot inspirado en bacterias, o (2) grandes enjambres de bacterias vivas para impulsar el transporte de NP localizado. Las micropropulsoras artificiales y naturales ayudaron al proceso al promover la convección impulsada magnéticamente en una ubicación definida en una configuración magnetofluídica con potencial para aplicaciones terapéuticas.
El microbot sintético imitó la propulsión bacteriana utilizando un flagelo bacteriano artificial (ABF), mientras que los densos enjambres de bacterias magnetotácticas (MTB) aprovechadas por Schuerle et al. Ocurrió naturalmente como procariotas gramnegativos ( Magnetospirillum magneticum ) con propiedades magnéticas. Los científicos esperan que los resultados superen las barreras de transporte existentes para mejorar la penetración del tejido NP a través del control inalámbrico y la convección local espacialmente precisa en el futuro.
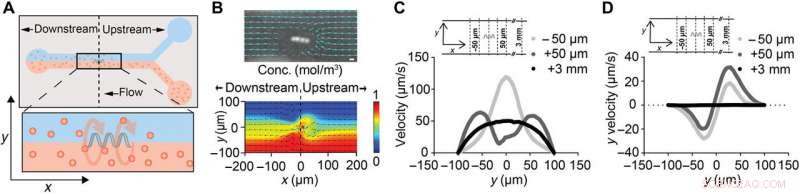
ABF perturba localmente el flujo de fluido. (A) Esquema de un canal de microfluidos de 200 μm de ancho con ABF suspendido (36 μm de largo, 10 μm de diámetro) colocado en el centro del canal (x, y, z) =(0, 0, 0). El canal superior contiene agua, mientras que el canal inferior contiene NP fluorescentes de 200 nm. (B) Instantánea de ABF en un canal de 200 μm de ancho que perturba las trayectorias seguidas de las NP fluorescentes de 200 nm que indican el flujo de fluido. Barra de escala (arriba), 10 μm. Una simulación numérica de flujo de dos fluidos con un ABF en la interfaz, con color que indica la distribución de la concentración (rojo, 1 mol / m3; azul, 0 mol / m3) de especies moleculares (abajo). (C) Perfil de velocidad en posiciones aguas arriba y aguas abajo del ABF. Para el control en x =+3 mm, Se simuló un perfil laminar no perturbado con una velocidad máxima de 50 μm / s. Tanto en x =+50 μm (aguas arriba) como en x =−50 μm (aguas abajo), se predice un aumento en las velocidades máximas, con el pico desplazado más cerca de la pared del canal para el caso aguas arriba. (D) Resultados de la simulación para el componente de velocidad y uy (ortogonal hacia y fuera del canal) en las mismas posiciones que (C). En las proximidades de la ABF, Se predice un empujón dirigido ortogonal a la dirección del flujo hacia la pared del canal. Crédito:Science Advances, doi:10.1126 / sciadv.aav4803
Schuerle y col. diseñó el ABF magnético utilizando litografía tridimensional (3-D) y deposición de metal, como se informó anteriormente. Los microrobots bioinspirados imitaron los flagelos giratorios para una locomoción eficiente basada en la propulsión a microescala, donde dominan las fuerzas de arrastre viscosas. Controlaron el movimiento ABF con campos magnéticos uniformes en rotación 3-D utilizando una configuración de control magnético inalámbrico que contenía electroimanes dispuestos alrededor de un solo hemisferio.
Luego montaron la configuración en un microscopio invertido para rastrear los movimientos de los microrobots controlados. Los campos magnéticos giratorios (RMF) permitieron la propulsión hacia adelante y el flujo convectivo en el fluido circundante y cuando los científicos sumergieron el ABF en una suspensión de NP fluorescentes, observaron un flujo controlado para el transporte masivo de las NP.
En el experimento, Construyeron la capa inferior del canal de microfluidos para contener las NP de 200 nm de tamaño similar al utilizado en aplicaciones clínicas. mientras que en la capa superior fluida mantuvieron una suspensión de medio acuoso puro. Los científicos colocaron el ABF en el centro de la configuración para mantener su posición contra el flujo controlando el flujo de fluido en la configuración. Esta disposición del ABF en un canal de microfluidos interrumpió el flujo laminar para producir convección, que transportó NP desde la capa de fluido en la parte inferior a la capa superior, para llegar a la pared del canal, es decir., la ubicación de interés.
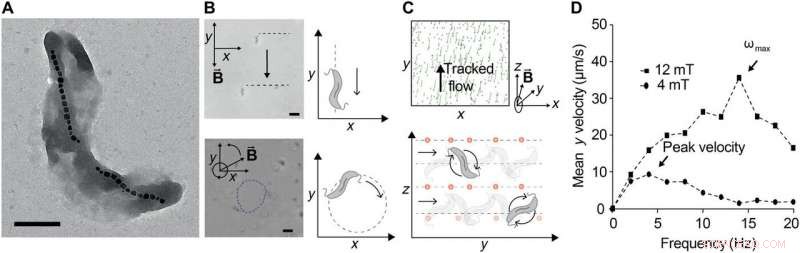
Bombeo ferrohidrodinámico con enjambres controlados de MTB. (A) Micrografía electrónica de transmisión de M. cepa magnética AMB-1. Barra de escala, 0,5 μm. Los magnetosomas son claramente visibles, aquí formado en dos cadenas distintas de cristales de óxido de hierro. (B) Control de AMB-1 bajo campos magnéticos estáticos (arriba) y campos magnéticos que giran en el plano a 1 Hz. Barra de escala (inferior), 5 μm. (C) Imágenes posprocesadas de seguimiento, co-suspendido, no magnético, NP fluorescentes utilizadas para observar los campos de flujo generados por un enjambre de MTB expuestos a un campo magnético de 12 mT que gira a 10 Hz en el plano y-z. Las trazas en verde corresponden a trayectorias de viaje en 12 fotogramas (~ 1 s). Las posiciones se calculan utilizando un filtro de paso de banda con un diámetro de 25 píxeles, seguido de la búsqueda de picos (arriba). El movimiento bacteriano se puede dirigir cambiando la dirección del vector del campo magnético giratorio, porque el MTB se traslada dentro del plano de rotación (abajo). Para un vector RMF alrededor del eje x, las bacterias giran a lo largo de y, generando un flujo que transporta NPs a lo largo de y. (D) La velocidad de traslación se representa frente a la frecuencia de rotación aplicada a dos intensidades de campo magnético diferentes. La velocidad de traslación aumenta con la frecuencia inicialmente, pero a frecuencias suficientemente altas, disminuye porque el par de arrastre fluídico supera el par magnético para evitar que se mantengan al día con la rotación del campo. La frecuencia máxima sincronizada, también correspondiente a la máxima velocidad de traslación, se denomina frecuencia de salida ωmáx. Cuando aumenta la intensidad del campo magnético, la frecuencia de salida aumenta, como se observó. Crédito:Science Advances, doi:10.1126 / sciadv.aav4803
Los científicos también desarrollaron un modelo de flujo de un solo fluido en un microcanal para formar un microvaso bioinspirado con escalas biomiméticas y tasas de flujo de fluidos. El modelo contenía colágeno concentrado en el centro que imitaba la matriz extracelular nativa. Usando el dispositivo, Schuerle y col. cuantificó la intensidad fluorescente en la matriz biomimética para probar si el ABF controlado magnéticamente podría mejorar el transporte de masa de NP marcadas con fluorescencia en la matriz que imita el tejido. Los resultados indicaron que los ABF estaban limitados como micropropulsores convectivos en vasos más pequeños, pero esto se puede cambiar escalando la estructura ABF para adaptarse al tamaño del canal en el futuro.
Los científicos consideraron a continuación los efectos de todo un enjambre de hélices de microrobot más pequeñas. Para esto, Schuerle y col. seleccionó la cepa de MTB de tipo salvaje AMB-1 ( Magnetospirillum magneticum ) para formar magnetosomas. Los microorganismos produjeron de forma natural cadenas de partículas de óxido de hierro en las bicapas lipídicas de la membrana plasmática para manipular el movimiento mediante campos magnéticos externos. Si bien los investigadores habían utilizado MTB en estudios anteriores como posibles vehículos de administración de fármacos con campos magnéticos externos, Schuerle y col. utilizaron campos magnéticos rotacionales (RMF) en el presente trabajo. Los RMF forzaron el movimiento de un enjambre de MTB para impulsar su movimiento a través de un par magnético.
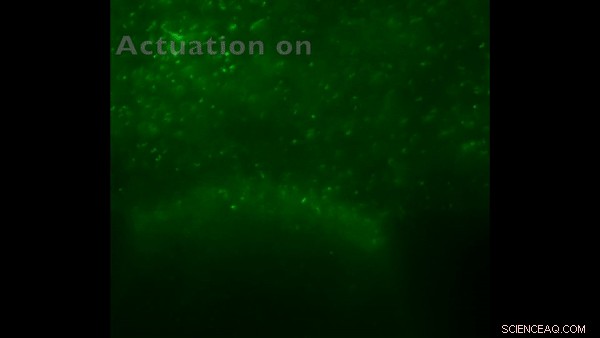
Control de MTB verde marcado con fluorescencia en dispositivo de microfluidos, cuando RMF está encendido / apagado. Crédito:Science Advances, doi:10.1126 / sciadv.aav4803
Los científicos redujeron la distancia promedio entre las bacterias utilizando una alta concentración de MTB para presionar a las células vecinas hacia adelante en enjambres tridimensionales dominados por fuerzas hidrodinámicas. No observaron agrupamiento o agregación de los magnetosomas de MTB cuando se expusieron a los RMF, ya que los magnetosomas estaban inherentemente protegidos por las membranas de las células bacterianas para controlar el flujo de fluidos. Schuerle y col. repitió los experimentos de biomimetismo utilizando un dispositivo de microfluidos que contenía colágeno para demostrar que los enjambres de MTB podían penetrar el colágeno, cuando se utilizaron concentraciones suficientemente altas de MTB.
De este modo, utilizando dos estrategias experimentales Schuerle et al. mejoró el transporte masivo de NP, mediante flujo convectivo generado por micropropulsores controlados magnéticamente. Los experimentos microrobóticos mostraron que ABF imitaba un flagelo bacteriano para ayudar a la acumulación y penetración de NP en una matriz de colágeno densa, cuando actuaban sobre ellos los RMF. Schuerle y col. proponen incluir tales ABF estacionarios en stents para desencadenar la liberación del fármaco y mejorar la penetración en un sitio de interés para contrarrestar la inflamación a demanda.
Con la segunda estrategia, se centraron en generar la misma técnica pero con cepas bacterianas magnetotácticas (MTB). Sobre la base del presente trabajo y las propiedades existentes de las MTB de alojamiento de tumores, los científicos visualizan enjambres controlados magnéticamente de MTB 3-D para transportar NP en el espacio de líquido intersticial de microambientes tumorales. Los científicos optimizarán la densidad de las bacterias para obtener una dosis compatible in vivo y el trabajo allanará el camino hacia nuevos estudios sobre micro y nanomateriales para el transporte de NP mejorado magnéticamente en nanomedicina clínica.
© 2019 Science X Network