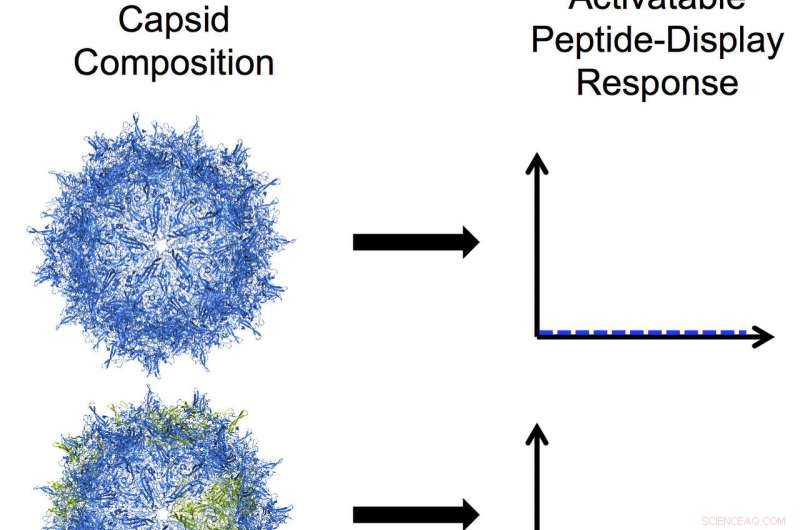
Los bioingenieros de la Universidad de Rice han desarrollado virus adenoasociados programables modificando una de las tres proteínas que se ensamblan en una capa dura llamada cápside. En esta ilustración, las subunidades azules en la cápside representan la proteína VP3 y las subunidades verdes representan un mutante truncado de VP2. De arriba a abajo:una cápside de solo VP3 que no muestra ningún péptido; una cápside en mosaico con una mayoría de VP3 y una pequeña cantidad del mutante VP2 que muestra un nivel bajo de presentación de péptidos activables; una cápside en mosaico con cantidades iguales de VP3 y VP2 mutante que muestra un alto nivel de presentación de péptidos activables; y una cápside mutante homomérica VP2 con un alto nivel de constante, pantalla de péptidos en forma de cepillo. Crédito:Nicole Thadani / Rice University
Al eliminar una proteína viral, Los científicos de la Universidad de Rice han descubierto un camino hacia los virus, Dispositivos a nanoescala que pueden administrar medicamentos a las células.
La proteína es una de las tres que forman la capa protectora, llamado la cápside, de virus adenoasociados naturales (AAV). Al hacer versiones progresivamente más pequeñas de la proteína, los investigadores crearon cápsides con habilidades únicas y aprendieron mucho sobre los mecanismos de AAV.
La investigación aparece en la revista American Chemical Society ACS Nano .
El bioingeniero de Rice, Junghae Suh, estudia la manipulación de AAV que no causan enfermedades para entregar cargas útiles como medicamentos de quimioterapia. Su investigación ha llevado al desarrollo de virus que pueden ser provocados por la luz o por proteasas extracelulares asociadas con ciertas enfermedades.
Los AAV son pequeños (alrededor de 25 nanómetros) y contienen una sola hebra de ADN dentro de cápsides resistentes que consisten en un mosaico de proteínas conocido como VP1, VP2 y VP3. Los AAV se han utilizado para administrar cargas útiles de terapia génica, pero nadie ha descubierto cómo las cápsides de AAV se reconfiguran físicamente cuando son activadas por estímulos externos, Dijo Suh. Ese fue el punto de partida de su laboratorio.
"Este virus tiene dominios intrínsecos de péptidos (proteínas pequeñas) ocultos dentro de la cápside, ", dijo." Cuando el virus infecta una célula, detecta el pH bajo y otros factores endosomales, y estos dominios peptídicos emergen sobre la superficie de la cápside del virus.
"Este cambio conformacional, que denominamos una 'visualización de péptidos activables, 'es importante para el virus porque los dominios externalizados rompen la membrana endosomal y permiten que el virus escape al citoplasma, "Suh dijo". Además, Las secuencias de localización nuclear en esos dominios permiten que el virus transite hacia el núcleo. Creíamos que podíamos reemplazar esa funcionalidad por otra ".

Nicole Thadani, izquierda, y Junghae Suh de Rice University han desarrollado virus adenoasociados programables que pueden usarse para administrar fármacos peptídicos. Crédito:Jeff Fitlow / Rice University
Suh y la autora principal y estudiante graduada de Rice, Nicole Thadani, creen que sus AAV mutantes pueden convertirse en "nanopartículas de biocomputación" que detectan y procesan las entradas ambientales y producen salidas controlables. Modificar la cápside es el primer paso.
De las tres proteínas naturales de la cápside, solo VP1 y VP2 pueden activarse para exponer sus péptidos funcionales, pero ninguno puede producir una cápside por sí solo. Los VP3 más cortos pueden formar cápsides por sí mismos, pero no muestran péptidos. En AAV naturales, Las proteínas VP3 superan en número a cada una de sus compadres 10 a 1.
Eso limita la cantidad de péptidos que se pueden exponer, entonces Suh, Thadani y sus coautores se propusieron cambiar la proporción. Eso los llevó a truncar VP2 y sintetizar cápsides en mosaico con VP3, resultando en una alteración exitosa del número de péptidos expuestos. Basado en investigaciones previas, insertaron una etiqueta de hexahistidina común que facilitó el seguimiento de la visualización de la superficie de la región del péptido.
"Queríamos aumentar la propiedad activable de la proteína más allá de lo que ocurre en la cápside del virus nativo, ", Dijo Thadani." En lugar de mostrar solo cinco copias del péptido por cápside, ahora podemos mostrar 20 o 30 y obtener más de la bioactividad que queremos ".
Luego hicieron una VP2 truncada capaz de formar una cápside por sí sola. "Los resultados fueron bastante sorprendentes, y no obvio para nosotros, "Suh dijo." Cortamos ese componente VP2 lo suficiente para formar lo que llamamos una cápside homomérica, donde toda la cápside está formada solo por esa subunidad mutante. Eso nos dio virus que parecen tener "pinceles" de péptidos que siempre están en la superficie.
"Una estructura viral como esa nunca se ha visto en la naturaleza, ", dijo." Tenemos una partícula con este cepillo de péptidos, con cabos sueltos por todas partes. Ahora queremos saber si podemos utilizar estos cabos sueltos para unir otras cosas o realizar otras funciones ".
Los AAV homoméricos muestran hasta 60 péptidos, mientras que los AAV en mosaico podrían programarse para responder a estímulos específicos de células o tejidos particulares y mostrar una menor cantidad deseada de péptidos, dijeron los investigadores.
"Los virus han evolucionado para invadir las células de forma muy eficaz, ", Dijo Suh." Queremos utilizar nuestro virus como una plataforma de nanopartículas para administrar terapias basadas en proteínas o péptidos de manera más eficiente en las células. Queremos aprovechar lo que la naturaleza ya ha creado, modifíquelo un poco y utilícelo para nuestros propósitos ".