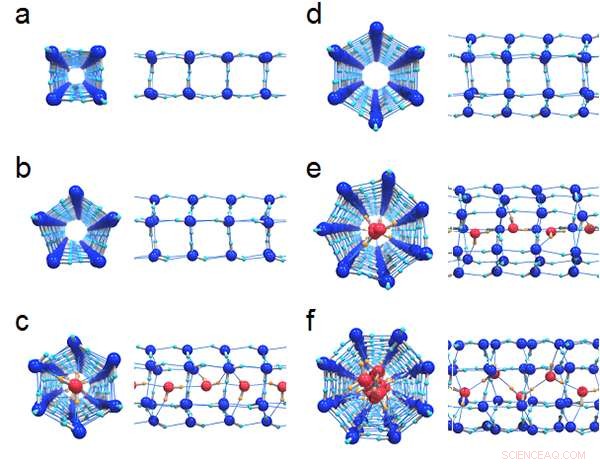
Figura 1:Estructuras de enlaces de hidrógeno de seis hielos formados en los nanotubos:(a) (4, 0) hielo, (b) (5, 0) hielo y (c) relleno (6, 0) hielo con un diámetro de 1,11 nm, (d) (6, 0) hielo, (e) lleno (7, 0) hielo y (f) lleno (8, 0) hielo con un diámetro de 1,25 nm. Las vistas superiores y la vista lateral correspondiente se dibujan en paralelo. Las moléculas de agua centrales que forman una cadena en los hielos llenos están coloreadas de rojo para distinguirlas de los anillos exteriores.
Muchos físicos no aceptan la idea de que un límite de fase sólido-líquido pueda terminar en un punto crítico, un estado único en el que dos fases pierden sus identidades separadas. ¿Por qué no lo hacen? El libro de texto autorizado de Landau y Lifshitz dice que "sólo podemos decir que una propiedad de simetría particular existe o no existe; ... El punto crítico, por lo tanto, no puede existir para tales fases". Pero desde 2001, La posibilidad del punto crítico sólido-líquido se ha informado en estudios de simulación por computadora de agua en nanoporos. De hecho, no hay pruebas rigurosas de la inexistencia del punto crítico sólido-líquido.
Kenji Mochizuki y Kenichiro Koga de la Universidad de Okayama proporcionaron evidencia inequívoca para respaldar el punto crítico sólido-líquido para una clase de agua en nanotubos mediante la realización de extensas simulaciones de dinámica molecular:separación macroscópica de fases sólido-líquido por debajo de una temperatura crítica Tc, capacidad de calor divergente y compresibilidad isotérmica alrededor de Tc, y los loci de la función de respuesta máxima (las líneas de Widom) por encima de Tc.
La Figura 1 muestra las estructuras de enlace de hidrógeno de seis cristales de hielo formados en nanotubos de carbono con diámetros de 1,11 nm y 1,25 nm. Los investigadores encontraron que todos los límites de fase de primer orden entre el hielo y el líquido finalmente dejaron de existir en los puntos críticos. como se muestra en la Figura 2. El diagrama de fase T-P es muy diferente al del agua a granel, donde las regiones de hielo están completamente rodeadas por los límites de fase de primer orden (líneas negras sólidas).
Los investigadores también dieron una explicación microscópica a un simple, aún sin respuesta, pregunta:¿cómo puede el agua líquida congelarse continuamente hasta convertirse en hielo cristalino? Encontraron fluctuaciones dinámicas de dominios microscópicos de agua y hielo cerca del punto crítico, una imagen microscópica del agua en el curso de una congelación o fusión gradual.
Los puntos críticos en el agua confinada son ubicuos y se pueden encontrar en condiciones ambientales ajustando el diámetro de los poros, y por lo tanto, una de las aplicaciones potenciales es utilizar las fluctuaciones críticas sintonizables para facilitar las reacciones químicas, cambios estructurales en moléculas biológicas, y formación de ensamblaje de biomoléculas en agua.
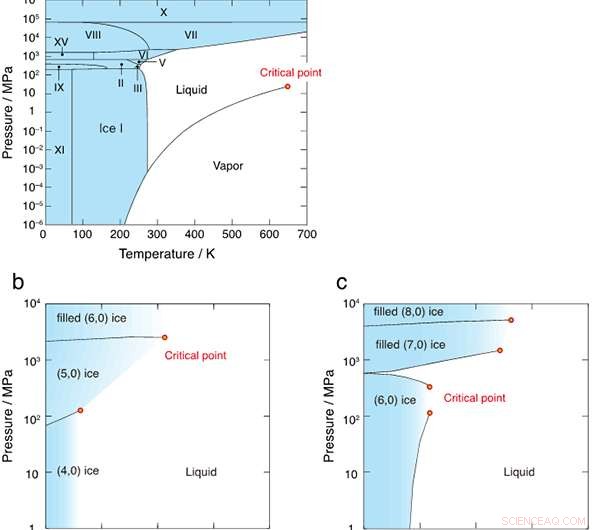
Figura 2:Diagramas de fase de (a) agua a granel, (b) agua confinada en el nanotubo de un diámetro de 1,11 nm, y (c) 1,25 nm. Los diagramas de fase de (b) y (c) se revelan en primer lugar en este estudio. Las regiones sólidas se colorean en azul y los puntos críticos se indican con círculos rojos.