
Fig. 1. Ilustración esquemática de un saco encerrado en una membrana de tres zonas, formado como una gota de HA en solución cae en una solución de PA. La capa más interna (1) es un gel de moléculas de HA. Está rodeado por una capa de nanofibras que se encuentran tangencialmente en la superficie del saco (2), de las cuales las nanofibras emergen perpendicularmente (3).
Las técnicas para crear materiales nanoestructurados complejos mediante el autoensamblaje de moléculas se han vuelto cada vez más sofisticadas. Pero llevar estas técnicas al ámbito biológico ha sido problemático. Recientemente, Los científicos de la Universidad Northwestern utilizaron el autoensamblaje en condiciones controladas para crear una membrana que consta de capas con estructuras claramente diferentes. Ahora, trabajando en Advanced Photon Source (APS) del Departamento de Energía de EE. UU., el equipo utilizó la dispersión de rayos X de ángulo pequeño (SAXS) para determinar mejor estas estructuras y estudiar cómo se forman. Esta nueva información allana el camino para el diseño y síntesis de estructuras jerárquicas con aplicaciones biomédicas.
Los péptidos anfífilos (PA) son cadenas de aminoácidos con punta de otras moléculas de modo que un extremo es hidrófilo (se mezcla bien con agua) y el otro es hidrófobo (no le gusta el agua). En solución acuosa, Los AP forman largos, nanofibras delgadas a medida que las cadenas de aminoácidos se unen a las cadenas adyacentes para formar láminas β. Los científicos de la Universidad Northwestern habían descubierto anteriormente que cuando una solución acuosa que contenía AP cargados positivamente se ponía en contacto con una solución acuosa de ácido hialurónico cargado negativamente (HA, una gran molécula biológica que se encuentra en los tejidos conectivos y otros), una densa, capa fibrosa formada en milisegundos, creando una barrera que impedía que las dos soluciones se mezclaran.
Más precisamente, los investigadores encontraron que la capa fibrosa evita que los AP agregados migren al lado de HA, pero permite que las moléculas de HA se insinúen lentamente a través de la barrera hacia el lado PA, en una escala de tiempo de minutos o más.
El resultado fue una estructura de membrana de tres zonas:una capa similar a un gel en el lado de HA, una estera fibrosa formada por nanofibras de PA que se encuentran en el plano de la interfaz entre las soluciones, y un revestimiento de fibras dirigido perpendicularmente lejos de la interfaz y formado por complejos unidos electrostáticamente de PA y HA (Fig. 1).
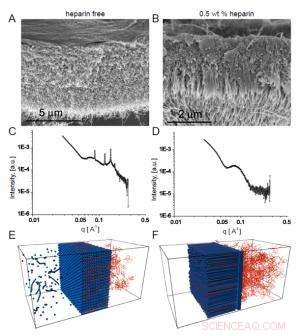
Fig. 2. Las micrografías electrónicas de barrido muestran la membrana homogénea que se forma en ausencia de heparina (A), mientras que en presencia de heparina se forma una estructura fibrosa transversal a la membrana (B).
El interés del equipo en estas membranas dependía de posibles usos biomédicos en los que la secuencia de péptidos que forma las nanofibras tendría una actividad biológica elegida. En un ejemplo, incorporaron una secuencia de unión a heparina para promover la angiogénesis (la formación de nuevos vasos sanguíneos), para que la membrana pueda ayudar con la reparación del tejido. Para que se forme la estructura de tres zonas, los investigadores encontraron que la solución de HA tenía que contener heparina en un cierto rango de concentración. La microscopía electrónica de barrido mostró claramente una estructura lineal que cruzaba la membrana que se formó cuando la heparina estaba presente al 0,5% en peso (Fig. 2a), en contraste con la apariencia más homogénea de la membrana creada en ausencia de heparina (Fig. 2b).
Los científicos recurrieron a SAXS en la línea de luz 5-ID-D del equipo de acceso colaborativo de DuPont-Northwestern-Dow en Argonne APS, una instalación para usuarios de la Oficina de Ciencias. Estos estudios dan una idea de la estructura precisa de las membranas de tres zonas y una mejor comprensión de la dinámica de su formación.
Las membranas sin heparina produjeron picos de Bragg bien definidos, mientras que las membranas de tres zonas no lo hicieron. Es más, las membranas que surgieron en presencia de concentraciones de heparina más pequeñas mostraron picos de Bragg más grandes que los producidos cuando la concentración de heparina fue mayor, indicando una competencia entre dos estructuras cuyo resultado dependía de los niveles de heparina.
Una serie temporal de mediciones de SAXS en un experimento sin heparina mostró que los picos de Bragg comenzaron a formarse unos minutos después de que las dos soluciones se pusieron en contacto. y alcanzó su fuerza máxima después de unos 45 minutos.
Interpretando los hallazgos de SAXS a la luz de sus experimentos previos y las propiedades conocidas de los AP y HA, los científicos explican las diferencias entre los dos tipos de membranas como resultado de diferentes tipos de agregación. En ausencia de heparina, el PA y el HA se unen en agregados nanoesféricos que se empaquetan en una disposición cúbica, durante un período de algunas decenas de minutos, para formar una membrana que genere picos de Bragg bien definidos.
Cuando hay heparina presente, por el contrario, se une fuertemente al PA y altera su interacción con las moléculas AH. En este caso, inmediatamente se forma una barrera de nanofibras paralelas a la interfaz de la solución, luego actúa como una barrera de difusión a través de la cual HA pasa lentamente. A medida que emerge del otro lado, se une a PA para formar nanofibras que crecen perpendiculares a la interfaz. Esta matriz ordenada de nanofibras no produce picos de Bragg.
La mayor comprensión y control de estos procesos derivados de esta investigación podría hacer posible la construcción de membranas bioactivas con una variedad de estructuras y propósitos.