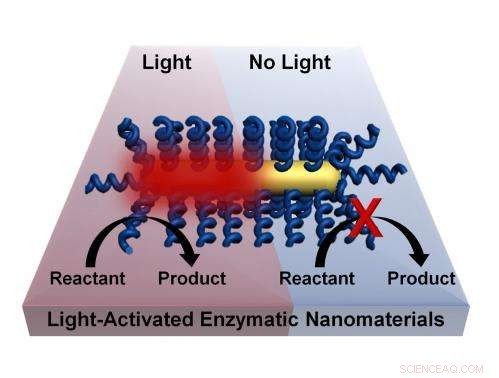
Los procesos químicos pueden activarse con luz sin la necesidad de calentar un material a granel mediante un proceso desarrollado por investigadores de la Universidad de Rice. La técnica consiste en recubrir nanobarras con enzimas termofílicas que se activan a altas temperaturas. La iluminación de la nanovarilla de oro plasmónica provoca un calentamiento muy localizado y activa la enzima. Crédito:Lori Pretzer / Rice University
(Phys.org) —Desde la primera bombilla de Edison, el calor ha sido un subproducto de la luz en su mayoría indeseable. Ahora, los investigadores de la Universidad de Rice están convirtiendo la luz en calor en el punto de necesidad, en la nanoescala, para desencadenar reacciones bioquímicas de forma remota a pedido.
El método creado por los laboratorios Rice de Michael Wong, Ramón González y Naomi Halas e informaron hoy en la revista American Chemical Society ACS Nano utiliza materiales derivados de microbios únicos (termófilos) que prosperan a altas temperaturas pero se apagan a temperatura ambiente.
El proyecto Rice dirigido por el becario postdoctoral Matthew Blankschien y la estudiante de posgrado Lori Pretzer combina enzimas de estas criaturas con nanopartículas de oro plasmónicas que se calientan cuando se exponen a la luz del infrarrojo cercano. Que activa las enzimas, que luego son capaces de llevar a cabo sus funciones.
Esto permite que los procesos químicos ocurran a temperaturas más bajas. Debido a que el calentamiento ocurre solo donde es necesario:en la superficie de la nanopartícula, donde activa la enzima, el ambiente se mantiene más fresco.
Blankschien cree que eso es fascinante.
"Básicamente, obtenemos los beneficios de la fabricación a alta temperatura sin necesidad de un entorno de alta temperatura, "dijo Blankschien, quien ganó la Beca Postdoctoral Peter and Ruth Nicholas hace dos años para trabajar en estas ideas. "El desafío era mantener la temperatura más alta en la nanopartícula, donde se activa la enzima, de afectar el medio ambiente que lo rodea ".
La técnica tiene un gran potencial para los procesos industriales que ahora requieren calor o se benefician del disparo remoto con luz.
"Las implicaciones son muy interesantes, "dijo Wong, profesor de ingeniería química y biomolecular y de química. "En la industria química, siempre existe la necesidad de mejores materiales catalíticos para que puedan ejecutar reacciones de manera más económica, más "verde" y más sostenible. No debe utilizar galones de solvente para hacer un miligramo de producto, incluso si puede venderlo por mucho dinero ".
Para la industria, El ahorro potencial de energía por sí solo puede hacer que valga la pena investigar el proceso del arroz. "Aquí estamos usando energía 'gratis', ", Dijo Wong." En lugar de necesitar una gran caldera para producir vapor, enciendes una bombilla de bajo consumo, como un LED. O abre una ventana ".
La partícula en el centro del proceso es una nanovarilla de oro de unos 10 nanómetros de ancho y 30 de largo que se calienta cuando recibe luz infrarroja cercana de un láser. Las varillas tienen el tamaño y la forma adecuados para reaccionar a la luz a unos 800 nanómetros. La luz excita los plasmones superficiales que se ondulan como el agua en una piscina. en este caso emitiendo energía en forma de calor.
El laboratorio de arroz de Halas es famoso por ser pionero en el uso de nanoconchas de oro (un material relacionado) para tratar el cáncer al atacar los tumores con partículas que se calientan a granel para matar los tumores desde el interior. La terapia se encuentra ahora en ensayos en humanos.
La nueva investigación toma un rumbo algo diferente al calentar nanopartículas cubiertas con una enzima termófila modelo, glucoquinasa, de Aeropyrum pernix. A. pernix es un microbio descubierto en 1996 que prospera cerca de respiraderos submarinos calientes frente a la costa de Japón. Alrededor de 176 grados Fahrenheit, A. pernix degrada la glucosa, un proceso necesario para casi todos los seres vivos. La enzima se puede calentar y enfriar repetidamente.
En sus experimentos, Blankschien y Pretzer clonados, enzimas glucoquinasa purificadas y alteradas para que se adhieran a las nanopartículas de oro. A continuación, los complejos de enzima / nanopartículas se suspendieron en una solución y se analizaron para determinar la degradación de la glucosa. Cuando la solución se calentó a granel, encontraron que los complejos se volvieron altamente activos a 176 grados, como se esperaba.
Luego, los complejos se encapsularon en una perla de alginato cálcico similar a un gel, lo que ayuda a mantener el calor adentro pero es lo suficientemente poroso como para permitir que las enzimas reaccionen con los materiales que lo rodean. Bajo calentamiento a granel, el rendimiento de las enzimas se redujo drásticamente porque las perlas aislaron demasiado bien las enzimas.
Pero cuando los complejos encapsulados fueron iluminados por continuos, luz láser de infrarrojo cercano, Funcionaron sustancialmente mejor que bajo calentamiento a granel mientras dejaban la solución a temperatura cercana a la ambiente. Los investigadores encontraron que los complejos eran lo suficientemente robustos para semanas de reutilización.
"Por inverosímil que parezca, Creo que a las empresas químicas les interesará la idea de utilizar la luz para fabricar productos químicos, ", Dijo Wong." Siempre están interesados en las nuevas tecnologías que pueden ayudar a fabricar productos químicos más baratos ".
Ve otros usos posibles para el nuevo enfoque en la producción de combustibles a partir de la degradación de la biomasa como la lignocelulosa; para la fabricación de medicamentos a pedido, tal vez a partir de tatuajes corporales con nanopartículas; o incluso para reducir las concentraciones de azúcar en sangre como una forma diferente de controlar la diabetes.
"Que ahora podamos hacer estas partículas es genial, ", Dijo Wong." La siguiente parte emocionante es pensar en cómo podemos implementarlos ".
Ryan Huschka, un coautor del artículo, es un ex estudiante de posgrado de Rice y ahora es profesor asistente de química en la Universidad de Newman. Halas es el profesor Stanley C.Moore en Ingeniería Eléctrica e Informática, profesor de ingeniería biomédica, química, física y astronomía y director del Laboratorio de Nanofotónica de Rice. Gonzales es profesor asociado de ingeniería química y biomolecular y también de bioingeniería.
La investigación fue apoyada por el Programa de Becas Postdoctorales Peter y Ruth Nicholas administrado por el Instituto Richard E. Smalley de Ciencia y Tecnología a Nanoescala, el Programa de premios Hamill Innovations del Instituto de Biociencias y Bioingeniería de la Universidad de Rice, el Fondo de Iniciativas de la Facultad de la Universidad de Rice, la Fundación Robert A. Welch, la Beca de la Facultad de Ciencias e Ingeniería de Seguridad Nacional, la Agencia de Reducción de Amenazas de Defensa, la Oficina de Investigación Científica de la Fuerza Aérea y la Fundación Nacional de Ciencias.