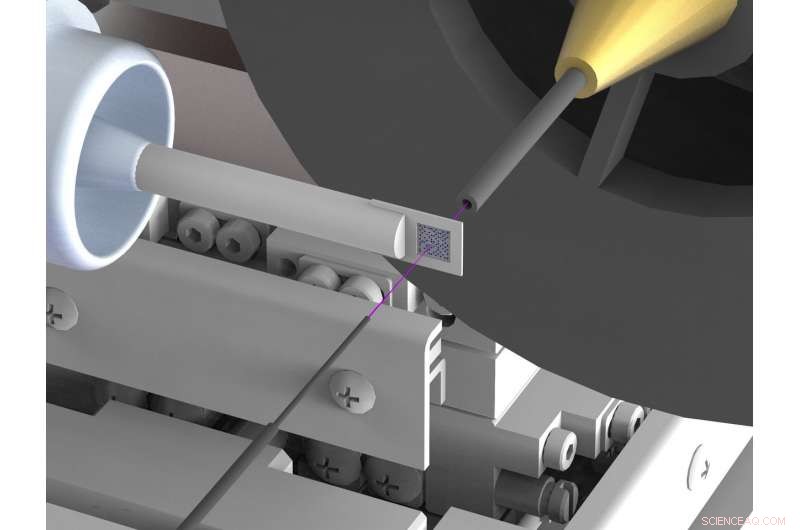
Una configuración recientemente desarrollada reduce enormemente la dispersión de fondo en el análisis de la estructura de rayos X de biomoléculas como proteínas en fuentes de rayos X de sincrotrón. La dispersión a menudo obstaculiza las determinaciones de estructura de alta resolución. Lograr esto, el haz de rayos X (resaltado en rosa) está encerrado en capilares de metal delgados poco antes y detrás de la muestra y el aire que rodea inmediatamente a la muestra se reemplaza por una corriente de gas helio. Crédito:DESY, Julian Bergtholdt
Una configuración experimental recientemente desarrollada permite la determinación de la estructura de rayos X de biomoléculas como proteínas con muestras mucho más pequeñas y tiempos de exposición más cortos que antes. En las llamadas fuentes de sincrotrón, El cristal de proteína se puede estudiar de forma considerablemente más eficaz y rápida mediante el uso de rayos X de amplio espectro. Sin embargo, debido a la gran cantidad de radiación dispersa, esto ha requerido hasta ahora cristales muy grandes. La configuración experimental recientemente desarrollada ahora permite reducir sustancialmente la radiación dispersa no deseada, de modo que los científicos han podido realizar cristalografía en serie utilizando radiación de sincrotrón de amplio espectro por primera vez. El equipo internacional dirigido por el científico de DESY, Alke Meents, publicó sus hallazgos de experimentos en Advanced Photon Source (APS) en los EE. UU. En la revista Comunicaciones de la naturaleza .
Las fuentes de sincrotrón son aceleradores de partículas circulares que producen radiación de rayos X brillante. Estas fuentes de rayos X son los caballos de batalla para la determinación de la estructura de las proteínas. Para dilucidar la estructura espacial de una proteína en particular, se cultivan cristales a partir de él y se investigan con rayos X en un sincrotrón. El cristal difracta los rayos X de una manera característica, y del patrón de difracción resultante la estructura interna del cristal, y con él se puede calcular la estructura de la proteína hasta el nivel atómico.
A diferencia de la cristalografía de rayos X convencional, que generalmente se lleva a cabo en uno o en un pequeño número de cristales de proteína grandes, La cristalografía en serie analiza entre cientos y cientos de miles de cristales muy pequeños. Luego, la información recopilada se fusiona para formar un conjunto de datos a partir del cual se puede deducir la estructura cristalina. Este método ya se ha aplicado con frecuencia utilizando láseres de rayos X de electrones libres (XFEL). Además, mediante el empleo de pulsos de rayos X muy cortos de XFEL, Las reacciones químicas y enzimáticas se pueden estudiar en intervalos de tiempo cortos.

Imagen de difracción de un cristal de proteína en policromático, Rayos X "rosa". En comparación con las imágenes de difracción de rayos X monocromáticas, la imagen policromática contiene mucha más información y se requieren menos cristales para determinar la estructura de la proteína. Crédito:DESY, Max Wiedorn
"La cristalografía en serie también se puede realizar fácilmente utilizando fuentes de sincrotrón. Sin embargo, las mediciones toman más tiempo con esas fuentes, porque utilizan rayos X monocromáticos de un color específico, resultando en un bajo flujo de rayos X, "explica Henry Chapman, científico principal de DESY y coautor del artículo. En sincrotrones, Por lo general, solo se usa una banda estrecha de longitudes de onda de rayos X para este tipo de análisis, de modo que solo se utilice una pequeña fracción de los fotones de rayos X disponibles para el experimento. "Además, necesitamos muchos cristales para recopilar un conjunto completo de datos, a menudo varias decenas de miles. Dado que los tiempos de exposición son relativamente largos con un sincrotrón, la única forma de estudiar reacciones rápidas ha sido con un láser de rayos X, "dice Chapman.
Al utilizar el llamado haz policromático "rosa", Ahora también se pueden realizar experimentos de cristalografía en serie con tiempos de exposición muy cortos en fuentes de radiación de sincrotrón. En comparación con el haz monocromático habitual, el amplio espectro aumenta el número de fotones de rayos X disponibles para realizar una medición. Como tomar fotografías en un día muy soleado, se pueden hacer fotografías con tiempos de exposición más cortos, lo que significa que las reacciones rápidas se pueden examinar utilizando fuentes de radiación de sincrotrón. Los experimentos en sí también se pueden llevar a cabo con menos cristales, ya que el amplio espectro proporciona patrones de difracción "coloridos" más intrincados con más información sobre la estructura molecular que el uso de rayos X monocromáticos de un solo "color".
Hasta ahora, sin embargo, no ha sido posible llevar a cabo cristalografía en serie utilizando el rayo rosa porque las mediciones se ven gravemente afectadas por los altos niveles de fondo producidos con rayos tan fuertes. "El fondo no deseado en los patrones medidos se produce porque los rayos X utilizados para sondear la muestra no solo son dispersados por las moléculas en el cristal mismo, sino también por el portamuestras y el aire circundante, "explica Max Wiedorn, DESY coautor del artículo. "La señal real medida durante los experimentos con el rayo rosa se distribuye entre los muchos" colores ", lo que significa que la radiación de fondo dispersa tiene un impacto claramente más negativo en las mediciones que en el caso de la radiación monocromática ".
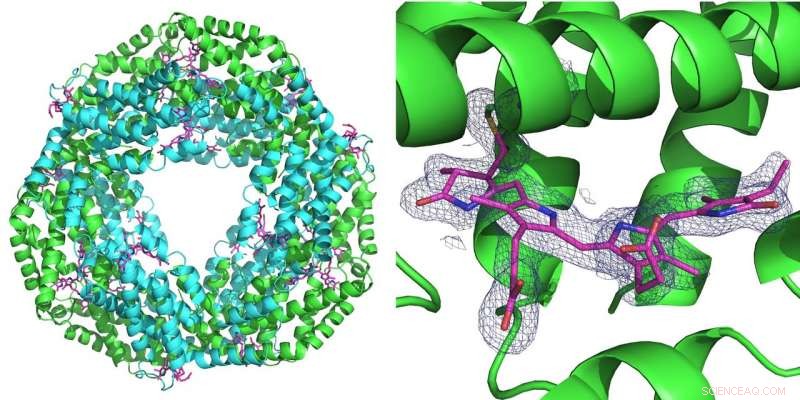
Izquierda:La primera medición realizada con la nueva configuración se realizó en la proteína ficocianina que desempeña un papel en la fotosíntesis en cianobacterias. Forma un anillo de seis moléculas dobles (heterodímeros). En cada heterodímero se pueden unir tres moléculas de ficocianobilina (rosa). Derecha:la cuadrícula azul representa la densidad electrónica de una molécula de ficocianobilina unida. Ambas estructuras se calcularon a partir de solo 52 imágenes de difracción grabadas con el rayo rosa de la Fuente de Fotones Avanzada (APS) en la línea de luz de BioCARS. Crédito:DESY, Julia Lieske
Por lo tanto, los científicos han ideado una nueva configuración, que suprime en gran medida la radiación dispersa no deseada. Utilizan un portamuestras de silicona, que no dispersa los rayos X; además, garantizan que haya muy poco aire en la trayectoria del haz de rayos X. Lograr esto, el haz de rayos X está encerrado en un tubo de metal delgado justo antes y detrás de la muestra, que evita que la radiación dispersa llegue a la cámara de rayos X. También, el aire que rodea inmediatamente a la muestra se sustituye por una corriente de gas helio, que causa menos dispersión que el aire. Al suprimir la radiación dispersa, Los científicos han logrado ahora por primera vez determinar la estructura tridimensional de dos proteínas con una precisión muy alta mediante cristalografía en serie de haz rosa en un sincrotrón. Las mediciones correspondientes se realizaron en la línea de luz BioCARS de Advanced Photon Source (APS) en el Laboratorio Nacional Argonne en los Estados Unidos.
"Una gran ventaja de este método es que se puede utilizar para realizar estudios muy precisos de las estructuras de las proteínas, pero solo requiere una fracción del material de muestra, "explica Meents del Center for Free Electron Laser Science (CFEL), una cooperación de DESY, la Universidad de Hamburgo y la Sociedad Alemana Max Planck .. "Por el contrario, El pequeño tamaño de la muestra y la velocidad del método significan que se pueden tomar una gran cantidad de mediciones en un corto espacio de tiempo. por ejemplo en la investigación farmacéutica, donde uno quisiera saber qué sustancias activas potenciales se unen a una proteína específica que está involucrada en una enfermedad ". Además, el nuevo método requiere mucho menos tiempo para realizar todo el experimento, lo que permitirá mediciones de alto rendimiento de estructuras cristalinas.
Es más, porque las mediciones se pueden realizar a temperatura ambiente, Los cambios estructurales, como los que se producen cuando una sustancia activa se une a una proteína objetivo, pueden estudiarse en el futuro a lo largo del tiempo. El nuevo método logra una resolución temporal muy alta de 100 picosegundos, algo que no era posible en los sincrotrones con los rayos X monocromáticos utilizados en el pasado. Un picosegundo es una millonésima de millonésima de segundo. Un rayo de luz viaja unos tres centímetros en 100 picosegundos.