
Radiografía de la boquilla de trabajo, mostrando la corriente de proteína interna rodeada por el chorro de etanol. Crédito:Dominik Oberthuer, DESY
Los científicos están interesados en la estructura espacial de las proteínas para aprender sobre el funcionamiento de estas biomoléculas. Este conocimiento puede conducir a una mejor comprensión de las funciones de las biomoléculas y a medicamentos personalizados. La cristalografía de rayos X es la principal herramienta para resolver las estructuras de las proteínas. Sin embargo, requiere cristales en crecimiento de las proteínas que se están investigando. Cuando los rayos X golpean estos cristales, se difractan de los átomos para formar un patrón característico a partir del cual se puede calcular la estructura espacial del cristal y, por lo tanto, las moléculas de proteína.
Sin embargo, a muchas proteínas no les gusta ser comprimidas en cristales, ya que contradice su estado natural. "El crecimiento de cristales de proteína es complejo. La cantidad de proteína que se puede producir a menudo se limita a unas millonésimas de gramo, Y a menudo, solo se pueden obtener cristales muy diminutos, "dice Dominik Oberthür de DESY, autor principal del informe. Con los destellos extremadamente brillantes de los láseres de rayos X de electrones libres, incluso esos microcristales pueden analizarse, pero normalmente se necesitan miles de patrones de difracción para resolver la estructura de la proteína. Dado que los delicados microcristales se vaporizan completamente por el intenso destello de rayos X después de emitir su patrón de difracción, Se envía una corriente de microcristales frescos a través del rayo láser. Este concepto se conoce como cristalografía de rayos X en serie, y ha permitido el análisis de muchas proteínas previamente inaccesibles.
Todavía, incluso esos microcristales son difíciles de obtener, y solo una fracción es alcanzada por el destello de rayos X, dependiendo de la geometría de la corriente de cristal y los parámetros técnicos del láser de rayos X. "Los menos cristales, la menor cantidad de material proteico que necesite, cuanto más factible es el análisis, ", dice Oberthür. El equipo de Bajt concibió un nuevo concepto para la llamada boquilla de enfoque de doble flujo (DFFN) que reduce en gran medida el consumo de cristales de proteína. Por lo general, los cristales de proteína se inyectan con un tampón líquido portador en el haz de rayos X utilizando una boquilla especial. Para formar un chorro fino, el líquido portador se acelera mediante una rápida corriente de gas que rodea al líquido. Pero para formar un chorro estable, se necesita un caudal mínimo, por lo general, desperdicia la mayoría de los cristales en el chorro.

Concepto de la nueva boquilla:un rápido chorro de gas (blanco) acelera una corriente de etanol (azul) en la que se inyectan los cristales de proteína que llevan el tampón (verde). Crédito:Anton Barty, DESY, y Juraj Knoška, Universität Hamburg
Para superar estas dificultades, el equipo agregó etanol como un líquido secundario de "envoltura" entre el gas y el tampón. Esto hace que el gas acelere el líquido de la envoltura. Los cristales en su tampón se pueden inyectar como una corriente muy fina en el centro del chorro de etanol. "Antes, el tampón con los cristales tenía que hacer dos trabajos:formar un chorro estable y transportar cristales de proteína, "explicó Juraj Knoška, un doctorado estudiante de CFEL y la Universidad de Hamburgo, quien desarrolló las boquillas. "Nuestro enfoque separa estos roles y utiliza los líquidos que son mejores para el trabajo". El etanol tiene características ideales para formar un chorro muy estable, que fluye con solo una fina corriente del tampón portador de cristal en el centro. De esta manera, el caudal del tampón podría reducirse de unos 40 microlitros (millonésimas de litro) a solo dos microlitros por minuto. También, la multa, El flujo estable de nanocristales se puede mantener superpuesto con precisión con el pequeño haz del láser de rayos X. Además, la reducción del caudal global mejora la calidad de los patrones de difracción y la velocidad a la que los destellos de rayos X impactan realmente a los cristales.
"No solo reducimos el consumo de cristales, pero nuestra boquilla de enfoque de flujo doble también hace que el uso de la fuente de rayos X sea más eficiente al aumentar la velocidad a la que recolectamos patrones de difracción de alta calidad, "dice Bajt." Además, el uso del líquido de la vaina nos permite investigar proteínas en tampones que antes no se podían inyectar. Nuestro concepto amplía el espectro de biomoléculas que se pueden analizar ". Su equipo probó la nueva boquilla en el LCLS láser de rayos X del Laboratorio Nacional Acelerador SLAC en los EE. UU. Los científicos se unieron a diferentes grupos para resolver las estructuras de varias proteínas .
"Junto con el grupo del premio Nobel Roger Kornberg de la Universidad de Stanford, pudimos resolver la estructura de la enzima ARN polimerasa II a temperatura ambiente por primera vez, "explica Oberthür." Dado que la cristalografía a temperatura ambiente es un requisito previo para estudiar la dinámica estructural en detalle, esto abre la puerta para futuros estudios de resolución temporal o 'películas moleculares' con este importante sistema ". El nuevo dispositivo también se utilizó para analizar otras dos enzimas, una hidrogenasa unida a la membrana y una dioxigenasa, así como nanocristales de proteínas de origen natural, del capullo protector de un virus especializado (Cydia pomonella granulovirus, CpGV).
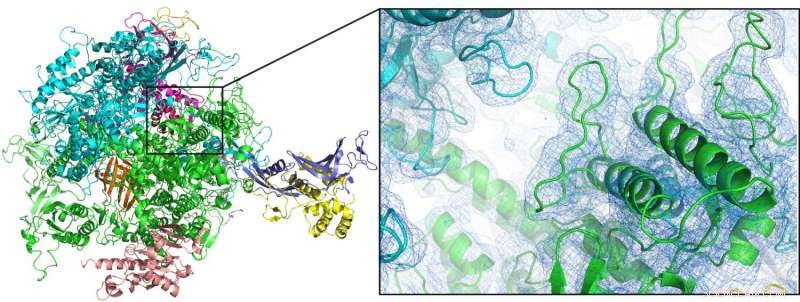
La primera estructura a temperatura ambiente de la enzima ARN polimerasa II (aquí mostrada como diagrama de dibujos animados) podría resolverse mediante cristalografía en serie de femtosegundos usando una boquilla de doble flujo enfocado. Crédito:Dave Bushnell, Universidad Stanford, y Dominik Oberthür, DESY
La boquilla de enfoque de doble flujo también elimina otro problema práctico de esta forma de inyección de chorro:por lo general, al borde de las boquillas convencionales, material amortiguador, Los cristales de proteína y hielo de agua se agregan con el tiempo para formar características similares a las de las gotas de agua. Lo mismo sucede con frecuencia en el fondo del tanque de captura debajo de la boquilla. Si estas estalactitas y estalagmitas de hielo de proteína crecen en el haz de rayos X, no solo inutilizan el patrón de difracción, sus reflejos pueden ser tan fuertes que destruyen el detector. Entonces, de vez en cuando, los experimentos deben suspenderse para eliminar las piedras de goteo de proteína-hielo. "El líquido de la cubierta de nuestra boquilla evita la formación de estructuras no deseadas. La boquilla de enfoque de doble flujo permitió condiciones experimentales estables durante muchas horas, "explica Oberthür.
"En todos los experimentos, la boquilla funcionó muy bien, "resume Bajt." Podríamos reducir el número de interrupciones de diez a cero en un turno, y esperamos que las estaciones experimentales en otros láseres de rayos X y en fuentes de luz de sincrotrón como el PETRA III de DESY también puedan beneficiarse de las ventajas de nuestro dispositivo ".