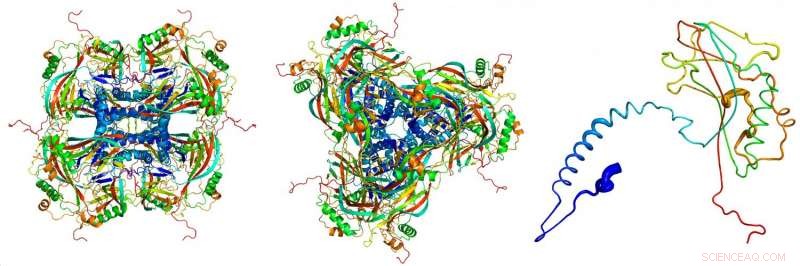
Modelo atómico de los cuerpos de oclusión cristalinos, derivado de las imágenes de difracción de rayos X registradas en el LCLS láser de rayos X de electrones libres en el Laboratorio Nacional Acelerador de SLAC. Las proteínas individuales (derecha) se unen para formar los bloques de construcción (izquierda, visto de lado; centrar, visto desde arriba) de los cuerpos de oclusión cristalinos. Crédito:Dominik Oberthuer, CFEL / DESY
Un equipo internacional de científicos ha utilizado pulsos de rayos X de alta intensidad para determinar la estructura de la envoltura proteica cristalina de un virus de insectos. Su análisis revela los detalles finos de los bloques de construcción que componen el capullo viral hasta una escala de 0,2 nanómetros (millonésimas de milímetro), acercándose a la resolución de escala de átomo. Los diminutos virus con su carcasa de cristal son, con mucho, los cristales de proteína más pequeños jamás analizados mediante cristalografía de rayos X. Esto abre nuevas oportunidades en el estudio de las estructuras proteicas, como informa el equipo encabezado por el científico principal de DESY, Henry Chapman, del Centro para la ciencia del láser de electrones libres en el procedimientos de la Academia Nacional de Ciencias ( PNAS ).
"El granulovirus ataca a ciertos insectos y los mata. Esto inicialmente los deja varados dentro del huésped en descomposición, por eso tiene que protegerse, tal vez por años, contra condiciones ambientales adversas como el calor, radiación ultravioleta y sequía, hasta que una vez más sea ingerido por un insecto. Lograr esto, el virus se envuelve en un capullo hecho de cristales de proteína, que solo se disuelve una vez que llega al intestino de un insecto, "explica Cornelius Gati de DESY, el autor principal del artículo. Estos virus son de particular interés para Peter Metcalf de la Universidad de Auckland en Nueva Zelanda y Johannes Jehle del Instituto Julius Kühn en Darmstadt. que se asoció con DESY para esta investigación. Los investigadores examinaron el capullo del Cydia pomonella granulovirus (CpGV), que infecta las orugas de la polilla de la manzana ( Cydia pomonella ) y se utiliza en agricultura como plaguicida biológico. El virus es inofensivo para los humanos.
Los científicos están interesados en la estructura espacial de las proteínas y otras biomoléculas porque esto arroja luz sobre la forma precisa en que funcionan. Esto ha llevado a una ciencia especializada conocida como biología estructural. "Durante los últimos 50 años, los científicos han determinado las estructuras de más de 100, 000 proteínas, "dice Chapman, quien también es profesor de física en la Universidad de Hamburgo. "De lejos, la herramienta más importante para esto es la cristalografía de rayos X". En este método, se hace crecer un cristal de la proteína bajo investigación y se irradia con rayos X brillantes. Esto produce un patrón de difracción característico, a partir del cual se puede calcular la estructura espacial del cristal y sus bloques de construcción.
"Uno de los grandes desafíos de este procedimiento es, sin embargo, haciendo crecer los cristales, "agrega Chapman. Muchas proteínas no se alinean fácilmente para formar cristales, porque ese no es su estado natural. Cuanto más pequeños sean los cristales que se pueden utilizar para el análisis, más fácil es cultivarlos, pero más difícil es medirlos. "Esperamos que en el futuro podamos prescindir por completo de los cristales en crecimiento y estudiar moléculas individuales directamente mediante rayos X". "dice Chapman, "por eso nos gustaría entender los límites".
"Estas partículas de virus nos proporcionaron los cristales de proteína más pequeños jamás utilizados para el análisis de estructuras de rayos X, "explica Gati. El cuerpo de oclusión (el virus" capullo ") tiene un volumen de alrededor de 0,01 micrómetros cúbicos, aproximadamente cien veces más pequeño que los cristales de proteína cultivados artificialmente más pequeños que hasta ahora se han analizado mediante técnicas cristalográficas.
Para romper este límite en tamaño de cristal, se necesitaba un haz de rayos X extremadamente brillante, que se obtuvo utilizando un llamado láser de electrones libres (FEL), en el que un haz de electrones de alta velocidad es guiado a través de un ondulador magnético que hace que emitan pulsos de rayos X similares a los de un láser.
Los científicos utilizaron el LCLS láser de electrones libres en el Laboratorio Nacional Acelerador SLAC en los EE. UU., y empleó ópticas para enfocar cada pulso de rayos X a un tamaño similar al de una de las partículas de virus. "Dirigir todo el poder del FEL a un pequeño virus lo exponía a tremendos niveles de radiación, "informa Gati, que ahora trabaja en SLAC. La dosis fue de 1.300 millones de grises; a modo de comparación:la dosis letal para los seres humanos es de alrededor de 50 grises.
La dosis de FEL también fue ciertamente letal para los virus:cada uno se vaporizó por completo con un solo pulso de rayos X. Pero el pulso de femtosegundos lleva la información de la estructura prístina al detector y la destrucción del virus ocurre solo después del paso del pulso. El análisis de la difracción registrada mostró que incluso los cristales de proteína diminutos que son bombardeados con dosis de radiación extremadamente altas pueden revelar su estructura a escala atómica.
"Las simulaciones basadas en nuestras mediciones sugieren que nuestro método probablemente pueda usarse para determinar la estructura de cristales aún más pequeños que consisten en solo cientos o miles de moléculas, "informa Chapman, quien también es miembro del Hamburg Center for Ultrafast Imaging (CUI). "Esto nos lleva un gran paso más hacia nuestro objetivo de analizar moléculas individuales".